



 有临
有临
 2023.10.19
2023.10.19
 1886
1886

9月27日晚,有临医药联合CMAC、Caidya(康缔亚)、迪时咨询及普瑞盛医药为观众带来一场精彩绝伦的知识盛宴——《临床试验全球数据标准(CDISC标准)中国实施专家共识草案讨论》。我们力邀有临来雅总经理张子豹博士(C3C前任主席,AP3C前任主席)、北京迪时咨询数据科学EVP吴崇胜博士(C3C现任主席)、Caidya(康缔亚)高级统计分析总监王军(C3C副主席)、诺华制药数据库开发与创新小组负责人魏志军(C3C核心成员)及普瑞盛医药数据科学事业部副总经理王海波,共同回顾CDISC标准,NMPA药物临床试验数据递交指导原则及《CDISC标准中国实施专家共识》草案,并深入探讨其在中国落地所面临的挑战和机遇。会后,我们整理并请专家回答了大量观众重点关注问题,以供业内同仁再次学习和分享。





Part 1 1 专家讨论+观众答疑
主持:
有临来雅总经理张子豹博士
(C3C前任主席,AP3C前任主席)
嘉宾:
北京迪时数据科学EVP吴崇胜博士(C3C现任主席)
Caidya(康缔亚)高级统计分析总监王军(C3C副主席)
诺华制药数据库开发与创新小组负责人魏志军(C3C核心成员)
普瑞盛医药数据科学事业部副总经理王海波

编者注:重复提问内容做了删减和分类,专家答复仅供参考。任何与法规指南相关内容,请结合实际情况判断,欢迎和各位专家保持沟通。
CDISC标准一般问题
1. CT一般用最新版本还是根据IG版本用不同的版本?
答:CT版本与医学编码(如MedDRA)版本类似,需要在研究开始、数据库锁定或NDA/BLA递交时,统一使用当时的最新版本。
2. 请教老师,谁需要了解CDASH?
答:数据管理人员、数据库开发人员、统计编程人员以及研究者等。
3. 项目过程中,MSG(Metadata Submission Guidelines)必须要遵循吗?
答:建议遵循。
4. CRF设计如何更好的符合CDISC标准
答:请参照CDISC临床数据采集标准CDASH。必要时,还可参考SDTM标准及相关治疗领域用户指南(Therapeutic Area User Guide, TAUG)。
5. 受试者 rescreening 的话 subjid应该怎么做比较合适?
答:同一受试者在多次筛选时USUBJID应相同,但SUBJID应不同,相关信息可参考FDA技术遵从性指南(Technical Conformance Guide,TCG)。
CDISC中国或中文一般问题
6. CDISC国内外的差异有哪些?
答:CDISC标准本身无国内外差异。但各监管机构对数据递交具体要求可能有所不同。
7. 专家们好,咱们有中文官网吗?今天演示的信息标准从哪能查到?
答:无中文官网,但CDISC标准中文翻译稿可以在CDISC官网下载https://cdisc.org/translations/chinese。
答:C3C翻译了常用的CT,并且会根据需要扩充常用CT列表的翻译。实际使用时,如果有不在这些常用CT上的值,需要申办方根据需要,自行做中文的翻译。
9. 请问如何加入CDISC中国?
答:CDISC中国不定期招募志愿者,请关注CDISC中国公众号或参加CDISC用户微信群。另外也可以参加CDISC中国年会或当地CDISC用户组活动,与C3C成员沟通了解更多信息。
国内数据递交- compliance check问题
10. CDE 没有明确要求递交时做conformance check,是否在 review guide关于这部分内容可以直接省略?省略的话影响审评结果吗?
答:递交的研究数据需符合《药物临床试验数据递交指导原则(试行)》中的要求,如有不符合,需要在数据审阅说明中加以说明,必要时建议和CDE审评老师提前沟通。另外,在《药物临床试验数据递交指导原则(试行)》章节二(四)中,有要求包含“数据集所用编码(如utf-8、euc-cn等)及其它特殊情形说明等”,通常这类信息也包括在数据审阅说明文件中。
11. Pinnacle 21 report里需要用中文版CT做validation 吗?
答:NMPA的指导原则里,没有专门提符合性检查,但是需要符合指导原则的要求。因此申办方可以使用Pinnacle 21, 或者其他检查工具,比如SAS宏,或Python脚本、R脚本等,进行检查,使其数据和相应文档符合指导原则的要求。
国内数据递交-中文翻译或处理问题
12. 请问在产生中文数据集时,是否要在观测水平上与英文保持一致?比如AE,AE的sort key中包含 AEDECOD,翻译成中文后如果再排序将会和英文数据集的顺序不一致,针对类似问题,我们是否需要和英文数据集在观测水平上保持一致呢?
答:尽可能在观测记录水平上保持一致。原始的英文数据集中,应该有AESEQ, 或者ASEQ变量,可以用来保持原始顺序。XPT数据文件不保存排序信息,所以需要在转换到XPT格式之前做好排序工作。
13. 翻译工作是否可通过导入翻译好的excel文件进行merge?如果可以,应该如何实施QC?有什么推荐的QC方式吗?谢谢!
答:翻译工作需要确保翻译准确一致,并且没有信息截断。有符合资质的翻译团队进行QC,具体QC方式需要咨询有资质的翻译团队。从数据角度,可将excel文件理解为外部数据,需要对操作与处理(如 merge)工作进行质控,譬如双编程、人工审阅。
14. 英翻中项目,TLF的title,header,footnote需要用中文,TLF的主体部分需要吗?比如shift table里的访视信息?
答:一般来说,《药物临床试验数据递交指导原则(试行)》要求CSR正文中的表格内容为中文。
15. CSR里table 的主体内容也要翻译吗?比如shift table里的访视信息?
答:一般来说,CSR主体内容中的表格,需要是中文。交叉表格的访视信息,也需要中文。这里需要大家换位思考,方便审评老师的工作。
16. CSR 里title,header,footnote需要翻译成中文,table主体部分需要翻译成中文吗?比如shift table的访视信息是否需要翻译,如mean是否需要写成均值,还有listing里面,一些free text信息应该不用翻译吧?
答:参见问题14。
其它/未分类
17. 老师您好,我是初学者,想从事临床试验统计和数据管理方面的工作,老师有什么建议?从哪方面入手,比如考sas证书?
答:统计和数据管理是两个不同职位,要求大不相同。建议和相关从业人员沟通。另外,建议可先了解CDISC标准。
18. 除SAS外,有没有实用的作图软件?
答:实践中也常用R来作图。从监管当局角度来说,没有限定必需使用某一特定软件,比如SAS或R,但需要确保所用软件和程序已经过充分验证,符合行业软件验证要求。
19. 适应性设计的案例实施?
答:就适应性设计方法本身,可参考相应专著。CDISC标准对适应性设计临床试验与其它类型设计没有太多不同。
附录开放问题/话题
X1. 数据标准与自动化的关系?
答:规范化、标准化、自动化,再到AI辅助,是标准化实施的大方向。
X2. 外文数据库翻译,影像阅片,大数据数据库,自动化编程系统的设计以及Chatgpt 是比较感兴趣的话题,请从数据标准角度分享专家们的看法。
答:外文数据库的翻译,涉及到数据集标签,变量标签,受控术语,医学编码字典等等。C3C已经发布了数据集标签,变量标签的中文版本,以及常用的CT翻译。用户可以将这些内容建立自己的数据库,方便程序灵活调用。
影像阅片,现在人工智能也能做一些工作,再结合人工审阅等流程,应该是可以提高效率。需要用户自行探索AI+人工的流程,建立系统。
大数据数据库,自动化编程系统的设计,这些内容也是近些年的热点。大家可以到PharmaSUG的既往文章里搜索行业专家的分享。技术方案非常多,八仙过海,各显神通,需要结合用户公司的实际情况,进行实施。
ChatGPT国内无法正常访问。我们假设这里说的是大模型。大模型的原理相信感兴趣的用户有所了解,各模型预训练的资料还是相对公共的知识,没有各公司的私有知识专业。各家用户可以探索建立自己的知识库,喂给大模型进行模型微调,在不同的领域内一展拳脚。可以预见,在将来,数据管理,统计和编程,医学等各个流程中的常见任务,都可以从大模型获得不同的效率提升。当然建立知识库和模型微调,还是需要专业人士的协助。也欢迎大家在行业大会上多做分享,提升我们行业整体对大模型的应用水平。
X3. 建库和UAT测试的标准化流程以及数据管理标准化作为时下热门问题,请专家们从数据标准角度分享下看法。
答:尽可能按照临床试验数据采集标准CDASH 来进行库设计,必要时结合SDTM,确保建库质量;另外,可通过建设标准化的CRF模板库、治疗领域模板库、标准化的逻辑检查库及相应的检查程序、相关的元数据仓库及元数据驱动的自动化流程等,确保数据的单一真实来源性(single source of the truth),提升工作质量与效率,并充分利用现有编程技术包括RPA等(Robotic Process Automation),结合业务需求,最大程度实现业务流程自动化,包括测试自动化。
X4. 生物统计方法与数据标准的关系?
答:CDISC有多个标准关联到临床试验用到的统计方法和试验设计,其中ADaM标准可存放项目中用到的统计分析方法。CDISC的ADaM标准,也出了相应的常用统计方法示例,参见ADaM Examples in Commonly Used Statistical Analysis Methods | CDISC。另外,临床方案相关标准和治疗领域指南(TAUG)也涉及到。更多试验设计和统计方法请关注相关统计书籍和培训。
X5. CDISC实施的ABC建议?
答:知识的积累是一个过程,从现在开始,在项目中尽可能地实施CDISC标准,哪怕不是完全遵循,逐渐积累知识与经验,3-5个项目之后,感觉就不一样了。
X6. 请各位专家结合实际工作谈谈CDISC标准带来的价值,以及为何需要用数据标准?
答:当递交数据形成统一标准之后,对内可建立标准化的数据分析平台;对外能符合监管要求,减少监管部门的学习成本,既能加快新药审批速度,又能挖掘积累的数据价值,实现数据创新。且CDISC标准为一门迭代便捷、一劳永逸的专业技术,一旦掌握无须重复学习。特别对于行业新人而言,如果掌握了这个由无数专家建立的标准,就相当于已站在巨人的肩膀上,非常有利于个人的职业发展。
X7. 关于CDISC的执行建议和标准。
答:三种类型:最低要求、推荐标准(CDISC标准-部分符合)及最佳实践(CDISC标准-完全符合),建议越早开始越好。(详见后续专家共识)
X8. 中国何时能有自己标准的CDISC验证工具,加速中国药企的申报,提高监管部门效率,让更多更新的药物服务于群众?
答:我们已经在做关于数据递交的核验规则草案。这个规则目前还处于Draft状态,后续相应的公司都可以来做一些开发工具。
PART 2 背景介绍

王军先生 | Caidya(康缔亚)高级统计分析总监 (C3C副主席)
TOPIC 01 《CDISC标准以及中国临床试验数据递交 指导原则介绍》
一、CDISC标准简介
Clinical Data Interchange Standards Consortium(临床数据交换标准协会)是1996年成立的行业非盈利性组织。制定整个临床试验流程中的数据交换标准,提高临床研究的数据质量及加速试验流程,使药物更快到达病人手中,提升病人的健康水平。常用标准包括:临床数据采集标准CDASH、数据呈现标准SDTM、分析数据标准ADaM、受控术语CT、数据说明标准Define.xml等。(所有标准均可免费获取)
采用CDISC数据标准有利于研究者更好地开展临床试验,大幅提升数据的重用性,节省相关培训费用。同时便于审评机构进行评审,有效加快审评速度。
各国监管机构采纳CDISC标准情况
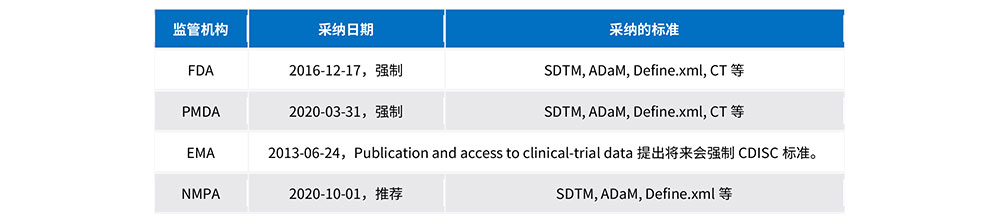
二、中国临床试验数据递交指导原则介绍
2020年7月20日,国家药监局药审中心发布关于《药物临床试验数据递交指导原则(试行)》的通告,推荐使用CDISC数据标准进行临床试验数据递交。化学药品、生物制品于2020年10月1日起实施;中药实施日期按国家药监局发布中药注册分类及申报资料要求的通告中相关规定执行。
 吴崇胜博士 | 迪时咨询共同创立者, 数据科学EVP
(C3C现任主席)
吴崇胜博士 | 迪时咨询共同创立者, 数据科学EVP
(C3C现任主席)
TOPIC 02 《中国CDISC标准实施专家共识草案(供讨论稿)》
一、标准化vs非标准化
数据标准化就是对数据集水平(Name、Description、Structure、Allowed Variables)、变量水平(Name、Label、Type、Format)以及值的水平(Controlled Terminology)作相同约定,并共同遵守。其优势在于:1. 能更为清晰、便捷地呈现数据结构,省时高效,可满足多人使用。2. 能加强数据的可预见性。
二、共识:CDISC标准中国实施策略
1. 最低要求:法规/指南
-满足目前NMPA法规/指南对数据递交的要求(详见直播回放)
-在适用的情况下对变量值进行标准化编码,如监管活动医学词典(MedDRA)等
2. 推荐标准:CDISC标准-部分符合
-满足最低标准要求
-满足CDISC标准对数据集和变量要求
-常用术语遵循CDISC CT
3. 最佳实践:CDISC标准-完全符合
-满足推荐标准要求(CDISC数据集及变量)
-满足CDISC标准对受控术语要求
* 以上所提到的CDISC标准包括SDTM(原始数据标准模型)和ADaM(分析数据标准模型)。在数据采集阶段,为方便后续的数据标准化,建议遵循CDASH标准。
三、中国逐步实施CDISC的策略
1. Dataset name and Structure: Fully Conformant
数据集名称和结构:可以完全遵循CDISC
2. Variable Name: Start from most popular ones
变量名称:常用的先遵循
3. Value-CT: Start from Core Ones
变量值 – CT:从最常用的开始,先遵循CDISC
most commonly used CT full set
*原则:越早实施越好
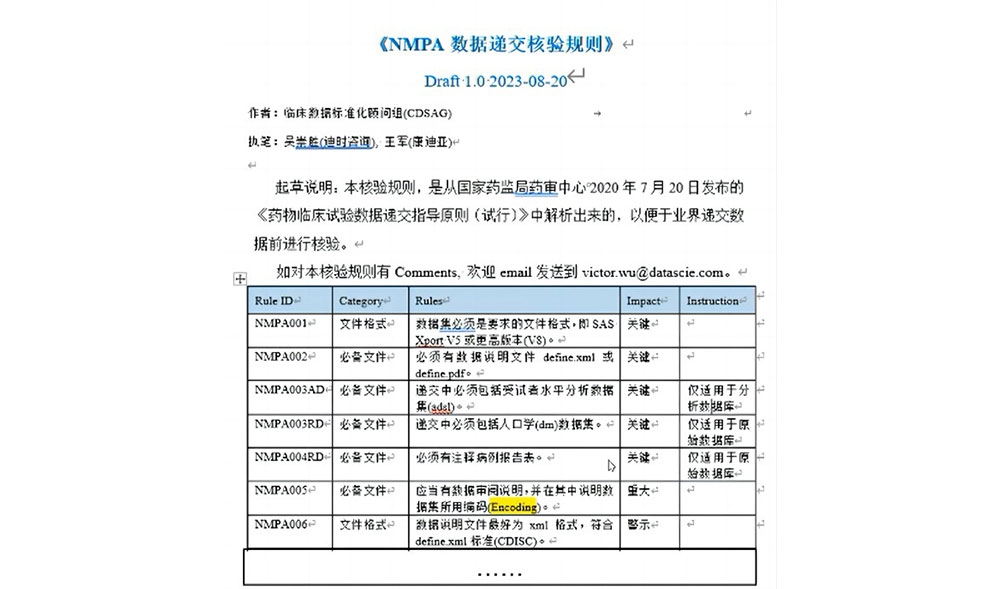
四、《NMPA数据递交核验规则》
目前监管机构还未发布核验规则,临床数据标准化顾问组(CDSAG)从指南中提取出来 如对本核验规则有任何comments, 欢迎发送邮件到核验规则起草团队(victor.wu@datascie.com)
五、CDISC标准文档翻译计划
版权隶属:Under Control of CDISC,Led by CDISC China (C3C) 已翻译并发布文档:SDTMIG V3.2、 ADaM IG V1.1、CT: 最常用CT 将来的翻译更新计划:
√ Metadata: 完整、及时更新翻译
√ IG: 保留网上 for review版本,不定稿
√ CT: 每年更新 / 增加翻译的条目
相关精彩内容请移步至
有临视频号,观看本期回放

为感谢所有新老朋友
对有临医学的支持
我们将抽取20位幸运读者
送出精美礼品,聊表心意
欢迎大家扫码参与抽奖
