



 有临
有临
 Dec 13,2019
Dec 13,2019
 8727
8727
盲态独立中心阅片(Blinded Independent Central Review, BICR)是目前肿瘤临床试验涉及影像学评估时最常采用的方法,即研究中心按临床试验方案要求采集影像数据后,连同必要的临床信息一同传输至第三方中心机构,并由未担任此次临床试验的其他任何职务的独立影像科医师对影像进行盲态阅片。
美国食品药品监督管理局(United States Food and Drug Administration, USFDA)在2007年发布的指南《Guidance for Industry: Clinical trial endpoints for the approval of cancer drugs and biologics》中建议当III期肿瘤临床试验的主要研究终点是以肿瘤测量为基础时(如PFS、ORR、TTP等),申办方应采用BICR [1] ;而在Ib早期临床试验中,使用BICR也可在剂量爬坡的初期疗效评估中起到关键作用,以为II期及III期临床试验的后续展开提供帮助。
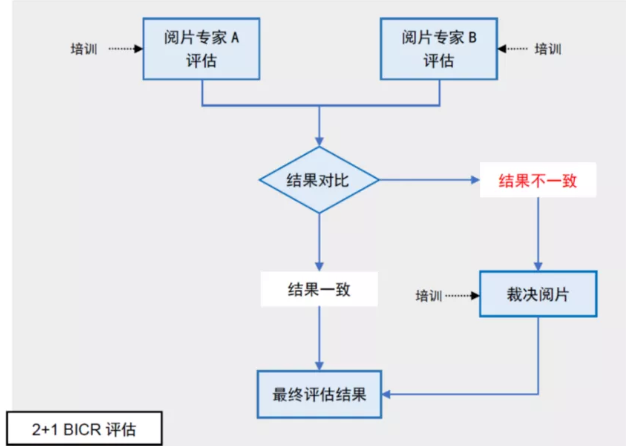
BICR有多种阅片模式可供选择,USFDA在2018年指南《Guidance for Industry: Clinical Trial Imaging Endpoint Process Standards》中则建议同一受试者的影像应由多位独立阅片人分别完成评估 [2] 。目前,BICR最常采用的阅片模式为“2位阅片人+1位裁决人”模式,也称“2+1”阅片模式,即先由两位基本阅片人在保持必要盲态的前提下背靠背完成同一位受试者的评估,若两者的评估结果相同,则得出最终结果,若结果不相同,则进入裁决阅片阶段,由第三位独立裁决阅片人在两个结果中选择“更准确”的一个作为最终结果。
申办方或监管部门经常会受扰于BICR中较频繁的裁决触发,进而对BICR结果的准确性及可靠性产生疑虑,但实质上,阅片本身就是一种主观性判断,即使不同的阅片人经历了相同标准化的培训、采用同样的评估标准、使用相同的阅片软件、保持相同的盲态且获知相同的临床信息,其对同一份影像依然可能具有不同的解读,某种程度上可以说,这种阅片人间评估结果的不一致(Discordance)导致的裁决触发是必然存在且不可避免的。
但是仍需指出的是,虽然采用“2+1”阅片模式的BICR过程中评估结果不一致的发生难以避免,在理解这些不一致发生原因的基础上,IRC和申办方/CRO/研究中心依然可以相互配合、采取适当的措施去降低不一致的发生,以保证阅片结果的可靠性,帮助临床试验结果数据通过相关监管机构的审查。
阅片人
独立阅片人是决定BICR结果的关键,挑选合适、高质量、高依从性的阅片人能显着提高评估结果的准确性,从而有效减少BICR过程中发生的不一致。IRC在挑选阅片人时应考虑到以下几个方面:
1 阅片人对临床试验使用的评估标准的了解程度
2 阅片人未担任此次临床试验的其他任何职务
3 阅片人对阅片过程保密重要性的理解
4 阅片人能符合方案规定的阅片时间安排
5 必要时替代阅片人的可能性
6 必要时临床信息的解读
IRC在挑选阅片人时首先应明确其在此次临床试验中未担任其他任何职务,再考虑阅片人擅长诊断的肿瘤领域及对临床试验所采用的评估标准的了解程度,同时阅片人的日程安排能确保及时完成BICR的阅片任务并应签署相应的《保密协议》,保证临床试验相关的任何信息不被泄露。
在挑选裁决阅片人时,在满足以上条件的同时,更应重点关注裁决阅片人的专业背景及相关经验,以确保其在裁决过程中能作出最正确的选择。
而在影像解读过程中,提供必要的临床信息可以更好的帮助阅片人进行评估,比如部分标准(如RECIST1.1)中当胸水、腹水等渗出性病变选为非靶病灶时,细胞学检测等临床信息的补充可以让阅片人作出更精确的定性评估,考虑到影像科医师对临床信息的把握程度可能相对不足,BICR可在影像科医师完成影像学评估后添加临床科室医师补充评估的流程,以进一步确保结果的准确性。
在确保阅片人具备相应的资质后,IRC应对阅片人展开不同程度的培训,帮助阅片人更好的参与到BICR的整个流程当中,建议培训的内容应包括(但不仅限于):
1 临床试验研究背景,尤其是涉及到影像解读的主要目标概述。
2 临床试验采用评估标准的实施细则,尤其临床试验预先设定的标准与通常使用的原标准有出入时,应对这些出入进行详细的讲解,以帮助阅片人了解这些特殊的定义。
3 计算机阅片软件的使用说明,IRC通常会使用计算机阅片软件,在病灶的测量、分析、疗效判定等各个方面为阅片人提供帮助,应指导阅片人熟悉各项软件中功能的使用,尤其该过程中涉及的独特软件数据锁定特征和密码保护特征时。
IRC在培训阅片人的同时应为阅片人提供特定的培训材料(如评估标准手册、阅片软件使用说明),这些材料可以从相应的阅片章程中截取,也可单独成册,以供阅片人在阅片过程中参考使用。同时IRC应采取适当的措施对阅片人的资质进行考核,当阅片人的阅片偏倚较高时,应和阅片人展开进一步讨论,必要时重新培训,以保证阅片人在正式阅片过程中不再发生此类偏倚。
阅片章程
对于采用BICR的临床试验,除了临床试验方案外,相应的阅片章程(Imaging Review Charter)同样必不可少。降低阅片人间评估结果不一致的关键在于整个BICR流程尽可能的“标准化”,而章程的存在意义就是为了更详细的阐述BICR在影像采集、解读、储存和数据转移等的过程标准。
而对于参与BICR的独立阅片人而言,章程中的影像解读部分是他们阅片过程中最重要的参考依据,以指导他们严格的遵循临床试验的要求完成独立影像学评估,章程的“标准化”程度越高,阅片人的依从性也将随之提高,从而有效的降低阅片人间评估结果的不一致。
USFDA在《Guidance for Industry: Clinical Trial Imaging Endpoint Process Standards》对阅片章程的编写有着详细的指导建议[2],需要特别提出的是,章程不是临床试验方案的组成部分,章程本身也并没有特定的格式或内容要求,可以是单一文件,也可以是影像采集方案、影像解读指导、数据转移计划或影像提交指导原则汇编的文件集,一切取 决于临床试验采用BICR的目的和申办方的具体要求。
因此对于影像解读部分,单独成册提供给参与BICR的阅片人是一个切实可行的解决方法,既可以作为培训材料,也可以在实际阅片过程中作为参考指导文件,出于这些目的,我们强烈建议阅片章程中应包含(但不仅限于)以下内容:
1 影像解读的主要目的:了解临床试验的主要目的和研究终点可以帮助阅片人更好的理解BICR在整个临床试验中的作用,以帮助其在阅片过程中更严谨的判断。
2 用于解读的影像的选择:应明确计划内影像、计划外影像、方案外影像的明确定义,以帮助阅片人了解应在何时评估哪些影像数据。
3 阅片时间安排和阅片过程:应阐述阅片相对于临床试验实施的时间安排,大部分情况下阅片人仅需在试验期间定期成批的解读影像,此时应规定批次大小、频率、并给出批次大小的理由,以减少回忆偏倚[2],而某些情况下(如PD确认)则需要阅片人及时完成阅片。
4 临床试验采用的评估标准解读:不同的临床试验会采用不同的评估标准,甚至会采用双标准或多标准,常见的有RECIST1.1、Lugano、RANO等,不同的评估标准在病灶选择、病灶测量、疗效评估上均有不同的规定,临床试验方案本身也可能存在不同于原标准的特殊规定,明确标准的具体定义可有效指导阅片人完成“标准化”影像解读,并减少阅片人间评估结果不一致的发生。
5 计算机阅片软件的使用说明:如上一章中建议培训内容所述,章程中也应附有详细的计算机阅片软件使用说明。
6 影像解读过程中特殊情况的处理:阅片人在影像解读过程中可能碰上各种突发情况,常见的诸如对评估标准理解产生歧义、计算机阅片软件发生故障等,应尽可能的列出常见的问题并给出解决方法,以帮助阅片人更好的完成阅片。
7 病例报告表(CRF)的使用:应描述CRF的形式和内容,给出相应的 填写说明,并强调特定的数据内容或标记,尤其是终点涉及定量成像的临床试验,从而最大程度避免CRF填写过程中出错的可能性,尽量避免因填写错误导致的评估结果不一致的发生。
结果的修改
在 BICR 中,为了遵从《FDA 21CFR-Part11》中的相关规定,保证阅片人评估结果的完整性和可靠性、防止评估结果进一步的修改,阅片人在每个时间点(包括基线及访视)评估完成后的数据锁定是必不可少的一个步骤,需锁定的内容包括 CRF 上所有的信息和阅片人在影像数据上所做的任何标记。
《Guidance for Industry: Clinical Trial Imaging Endpoint Process Standards》附录 A 的 “ 影像数据锁定过程(Imaging Data Lock Process) ” 部分提到某些情况下,阅片过程中可允许对之前已完成解读的影像进行再读,包括已进入锁定的数据[2] 。
现行 BICR 多为近实时(Near Real-time)阅片,即研究中心在完成影像的采集和上传后,阅片人在尽可能短的时间内(通常不超过 1 周)完成影像解读并得出评估结果,而在入组合格性评估(Eligibility Review)和PD确认中,时限将被进一步缩短,以保证申办方/研究中心能尽快的获知评估结果并完成相应的受试者入组/出组步骤。
但也正是时间的限制,阅片人在阅片时可能无法充分获知必要的信息(如临床信息),从而导致无法评估(NE)或错误的评估结果,大大提高了阅片人间评估结果不一致发生的频率。
而在肿瘤临床试验中,尤其以 PD-1抑制剂为代表的免疫抑制治疗中常有假性进展(Pseudo-Progression)的发生,经验不足的阅片人会因此过早地判定受试者总体疗效为 PD,其他类似的情况包括骨病灶的闪烁现象(Flare Phenomenon)及不明确新病灶的判定等,也是评估结果不一致出现的另一主要原因。
为了减少这种情况的出现,IRC 通常会允许阅片人在下次访视时补足所需的信息并对之前访视上的评估结果进行相应修正,但所有的修改均需明确的修改原因并记录在案;另一种可行的方法是在阅片人分别完成受试者所有时间点的近实时评估后再进行一次回顾性的总体评估(Global Review),以允许阅片人对受试者从基线到研究结束的整个过程进行再次评估,并将阅片人的首次评估结果及总体评估结果分开记录及锁定,只在总体评估结果不一致时才触发裁决[3] 。
该方法可有效减少不一致的发生,但只有在受试者研究完成时才能获知 BICR评估结果,可能无法满足部分临床试验的时效要求。
无论采取何种方式,IRC 在阅片章程中均应对数据锁定及潜在的结果修改进行明确的规定,对修改涉及的任何内容(包括病灶选择、病灶测量、总体疗效评估等)均需记录在案,且该记录不能修改。合理的结果修改可有效减少不一致的发生,但保证数据的完整性和可靠性始终是第一位的。