



 有临
有临
 Mar 27,2020
Mar 27,2020
 3075
3075
自年初新冠病毒爆发,至今已肆虐全球。可以说全世界的医护人员都在奋力帮助患者解脱病毒的侵蚀,医药企业也在寻找彻底的解决之道。不管是从抗病毒的角度,还是减轻病毒导致的肺损伤的角度,都涌现出一些大有希望的药物。其中吉利德科学(Gilead Sciences)公司研发的瑞德西韦(remdesivir)最是大放光彩,被叫做“人民的希望”。这两天关于该药获得美国FDA授予的孤儿药资格(orphan drug designation),而随后吉利德科学发布声明,宣布已经向美国FDA提出申请,要求FDA收回授予瑞德西韦的孤儿药资格,并且放弃与孤儿药资格相关的所有优惠权益。一系列新闻又将该药的研发推到了公众的面前。那么,什么是孤儿药资格,为什么业界人士会担心孤儿药资格可能会影响瑞德西韦的可及性?这就要从罕见病和孤儿药说起。

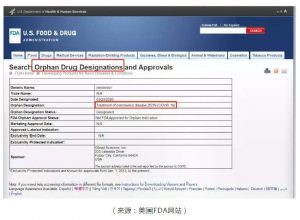
罕见病(Rare Disease),目前尚未有一个统一并被广泛接受的定义。某些定义是以患病人数为准则,一些地区的罕见病的定义还包括其他因素,例如是否有足够的治疗手段或者疾病的严重程度。
世界卫生组织将罕见疾病定义为“罹病人数占总人口0.65‰到1‰之间的疾病或病变” 。在美国患病人口保持在20万以内,或者患病率在1/1500的疾病,被称为罕见病。日本法律将患病人数在日本少于5万人,或患病率低于1/2500的疾病,定义为罕见病。欧盟对于罕见病的定义则是流行范围很小,发病时间长或者终生伴随,严重威胁到患者的生命,或者患者的身体因这种慢性病变得相当虚弱,需要多种专门手段进行治疗的疾病。同时对于流行范围小的标准定为患病率低于1/2000人。但即使统计学上患病率非常低,然而并不威胁到患者生命的疾病,则不认为是罕见病。
治疗罕见病的药物就叫孤儿药( Orphan Drug)。孤儿药的研发受限于罕见病的患病人数少,因而市场份额低,研发成本高。导致治疗罕见病的药物可及性极低,使得患有罕见病的人在一定层面上沦为弱势群体。因此,从现代公共治理的理念出发,很多国家将罕见病的医药保障纳入了公共卫生治理的范畴,给予激励政策,鼓励孤儿药研发。
美国FDA对于获得孤儿药资格的企业有以下优惠政策:一、享受孤儿药保护和市场排他性(七年独占的研发市场),且该保护不受专利的影响。二、税费优惠政策。孤儿药在临床试验期间,药物临床试验费用的50%可作为税收抵减税额, 并且可向前延伸3年,向后延伸15年;而且剩余的50%税额仍可减免,税费减免总额度最高可达临床研究总费用的70%。三、专项研发基金资助,主要用于资助孤儿药的临床试验。四、快速审评政策,孤儿药在临床试验申报中可享受各种加快审评的政策。FDA对成功开发儿童孤儿药产品的企业还会奖励优先审评券,使用该券可使该企业开发的其他药物同样获得优先审评资格。五、免除新药申请费用。六、协助药物的研究和临床试验设计。
在这样优惠的政策激励下,罕见病药品市场规模在过去的二十年间发展迅速,其中非罕见病适应症的销售量远超罕见病适应症的销售量。孤儿药资格认定及适应症的获批,带动了药品在常见病适应症的扩展。2018年全球市场销售金额排名前10的药品中,有8个已在美国获得孤儿药资格认定,其中有4个药品是以“孤儿药”身份上市并逐渐扩展多个罕见病或非罕见病适应症。全球销售排名第二的来那度胺在美国获批的所有适应症都是罕见病且获得了孤儿药资格认定。
从上述数据我们可以看到,瑞德西韦获得孤儿药的资格是美国FDA为促进该药的研发和审评的一大举措。不管因为怎样的考量因素,从吉利德科学申请放弃孤儿药资格的申请中,我们可以看到他们对自己研发药物的信心和为抗击疫情做贡献的美好愿望。
主要参考文献:
1. 董慧慧,陶四海. 国际孤儿药政策及其启示[J]. 临床医药文献电子杂志,2019,6(37):194.
2. 邵文斌,李杨阳,王菲,等. 中国罕见病药品可及性现状及解决建议[J]. 中国食品药品监管, 2019,2:8-15.