



 有临
有临
 2022.07.27
2022.07.27
 2066
2066
从临床前到药品上市,临床药理研究在新药研发全周期中起到怎样的桥梁作用?监管日益重视模型引导药物开发(MIDD)相关应用,从机构管理及研究者角度如何看待MIDD?临床药理研究,如何提高早期临床方案设计的科学性?7月19日,CMAC携手有临医药举办“临床药理在抗肿瘤新药研发中的价值与应用”线上直播沙龙,邀请浙江大学医学院第一附属医院教授申屠建中、蚌埠医学院第一附属医院国家药物临床试验机构常务副主任及I期临床试验研究室执行主任周焕、有临医药医学总监武亚玲三位行业专家参与直播分享,并进行主题演讲。从临床需求出发,站在申办方视角,解析临床药理学在抗肿瘤创新药早期临床试验中发挥的作用,从临床起始阶段就寻找更优解决方案,助力新药临床项目提速降本。

申屠建中 浙江大学医学院 第一附属医院教授
临床药理在抗肿瘤新药临床研究中的价值
近几年,中国创新药申报和批准数量逐年递增,其中抗肿瘤创新药IND获批的数量远超其他适应症。抗肿瘤创新药的研发面临诸多困难,为此,国家密集出台了50+个抗肿瘤药物研发相关和临床药理相关的指导原则,为抗肿瘤新药研发提供技术支持。 临床药理学在新药临床前研究至新药上市过程中起到桥梁作用。其贯穿于创新药上市前和后的全生命周期,通过剂量-暴露-效应关系及其内外影响因素的研究,逐步探索给药频率、剂量、疗程和适用人群的问题,为各期临床试验设计和注册提供依据。
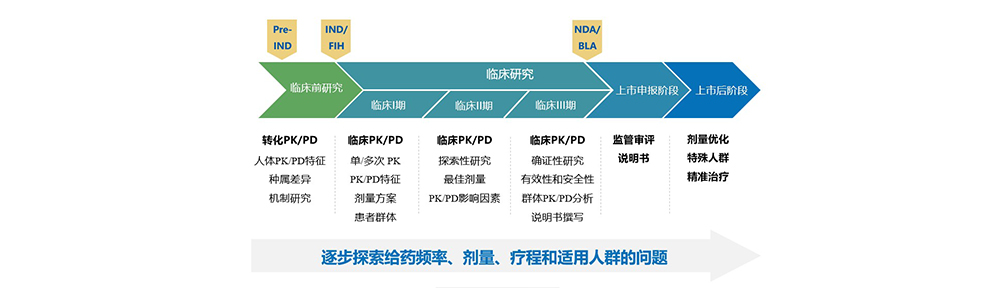
临床药理学引入数学模型精准定量分析并预测(定量药理学)药物处置和药物效应,同时可帮助深入挖掘药物在体内作用过程和机制等。新药研究中的临床药理学研究可实时、动态地开展并指导合理的临床开发策略制定,可降低新药研发成本,缩短新药上市时间。

周焕 蚌埠医学院第一附属医院 国家药物临床试验机构常务副主任及 I期临床试验研究室执行主任
抗肿瘤新药早期临床研究科学决策
抗肿瘤新药早期临床研究常在无标准治疗方案或标准治疗失败的肿瘤患者中开展,不仅需要考虑试验设计的科学性,如给药剂量及递增方案、患者的选择、PK/PD样本的采集等,也应重视肿瘤患者参加治疗的获益与风险。
早期临床研究中药物剂量-暴露-效应关系的探索和建模与模拟技术(MIDD)的引入,可指导合理用药方案的设定及相关风险因素的识别和控制,帮助研究者和申办者做出科学合理决策,提高新药研发效率,如首次人体试验(FIH)研究中,适当的MIDD可避免无效剂量、毒性剂量的爬坡,降低FIH研究风险。
蚌医一附院多措并举、跨越发展,打造以研究型病房为核心的一流临床试验中心,并与有临医药签署战略合作协议,整合资源,共同打造临床药理卓越中心,通过建模指导临床方案制定及试验实施,加速新药研发进程。

武亚玲 有临医药医学总监
抗肿瘤新药早期临床方案设计的考虑
医学、临床药理与生物分析,一直是紧密合作的关系。临床药理的研究结果可以为方案撰写及申办方的决策提供重要依据,而医学通过分析临床研究产生的试验数据,验证、丰富临床药理的内容,两者相辅相成,真正实现临床研究的动态决策,有效推动新药上市。
从方案设计、爬坡到扩展,每个阶段都会面临不同的数据问题和挑战。比如方案设计阶段,起始剂量计算、有效剂量预估、人体PK参数预测及采血点设计等;在爬坡阶段,何时终止爬坡、何时进行剂量扩展、如何优化给药频率等问题;在进入扩展阶段后,可能还存在优化给药方案及后续试验推荐剂量选择困难的问题。面对以上问题,医学通常借助公式来进行简单计算获得生物药的相关数据,但如果引入临床药理研究,基于模型计算所得到的结果会更精准。
从医学角度看临床药理,首先,如果试验药是作用于新靶点,在几乎没有可参考的对标化合物的情况下,引入临床药理研究将很大程度提升风险管控能力。当靶点已经有药物,但是新分子,也有一定的必要进行临床药理研究,尤其是大分子生物药。除此,如有非临床显示量效关系陡峭及治疗窗窄等特殊情况,也很有引入的必要。
有临医药提供专业的临床药理和生物分析服务,业务包括转化医学、PK/PD研究、pop PK/PD研究、小分子PK/PD生物分析及大分子PK/PD/ADA/Nab生物分析。核心团队成员来自医药行业大型上市公司或学术机构,具有丰富的项目经验和管理经验;另还有多名知名临床药理专家作为技术顾问进行技术指导,共同为项目保驾护航。有临医药以客户需求为导向,整合内部资源(医学/统计/临床运营/生物分析/临床药理等),致力于为更多创新药企业提供“整体最优”解决方案,让客户省心省力,快速推动临床研究。