



 有临
有临
 2022.10.27
2022.10.27
 1799
1799
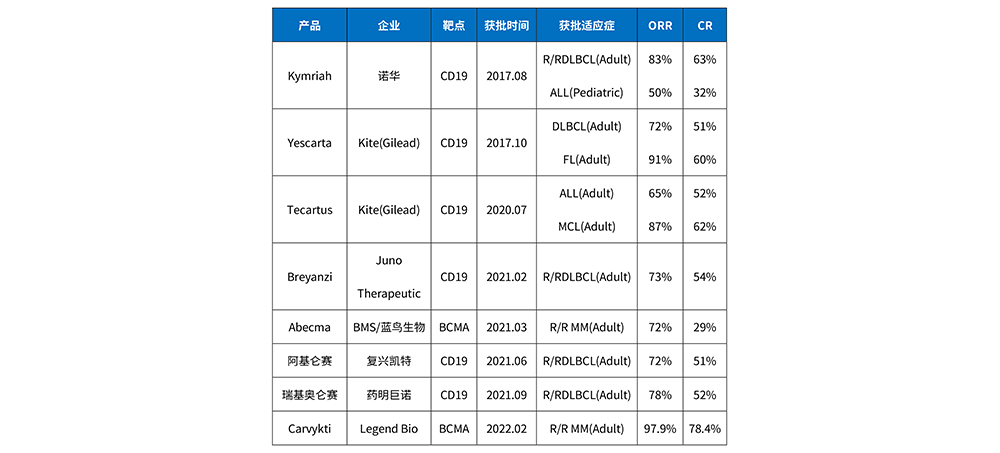
嵌合抗原受体T细胞(CAR-T)免疫疗法作为目前最有发展前景的肿瘤免疫疗法之一,已在血液系统肿瘤的治疗中取得显著成效。但由于CAR-T疗法风险较高,治疗过程中产生的脱靶效应及细胞因子风暴等毒性反应较为严重,有的甚至导致患者死亡,因此,准确评估、有效监测和早期识别并尽早干预毒性反应,对减少和降低CAR-T免疫疗法毒性反应的发生率和死亡率至关重要。截止目前全球共累计8款产品获批(见表1),其中两款来自中国,分别为复星凯特和药明巨诺的自体型CAR-T细胞。
表1:全球已上市CAR-T产品汇总
CAR-T免疫疗法的常见毒性反应有:脱靶效应、细胞因子释放综合征、肿瘤溶解综合征和神经毒性等,下面将一一介绍:
脱靶效应
脱靶效应是指由于嵌合抗原受体(CAR)针对的靶抗原并非肿瘤细胞所特有,且在正常组织中存在不同程度的表达,对靶抗原亲和力和杀伤能力强的CAR-T细胞在清除肿瘤的同时也会攻击正常组织,造成正常组织器官的损伤[1]。脱靶效应一般发生在1周左右,主要表现为相应器官受损的表现。使用相关抗体封闭正常组织表达的肿瘤相应抗原、控制CAR-T细胞首次输注剂量及改变CAR-T细胞输注途径可预防及降低脱靶效应[1]。
细胞因子释放综合征
细胞因子释放综合征(CRS)是输注CAR-T细胞后T细胞、B细胞、NK细胞及单核、巨噬细胞释放大量的炎性介质(如细胞因子和趋化因子)所导致的一组临床综合征[2],主要表现为恶心、头痛、肌肉疼痛、高热、低血压和皮疹等,严重时大量细胞因子释放会引起全身强烈的炎性反应,造成全身器官功能紊乱甚至危及生命,称为“细胞因子风暴”[3]。CRS通常发生在CAR-T治疗后的第1周内,且于1~2周内达到高峰[4]。患者在开始CAR-T治疗后的3周内如出现以下4种症状或体征之一,应疑为CRS:即发热,体温≥38℃;低血压,收缩压<90mmHg(1mmHg≈0.133kPa);动脉血氧饱和度<90%;出现器官毒性[5]。有研究[6]显示,70%经CAR-T细胞治疗后的患者均会出现CRS。控制CAR-T细胞首次输注剂量、密切监测生命体征和给予CRS相关毒性反应药物治疗可预防及控制CRS发生。托珠单抗(IL-6拮抗剂)是美国FDA批准用于细胞因子风暴的一线治疗药物,大多数出现细胞因子风暴的患者对托珠单抗和糖皮质激素治疗敏感。
肿瘤溶解综合征
肿瘤溶解综合征(TLS)也是CAR-T细胞治疗过程中的严重并发症之一,由于CAR-T细胞强大的杀伤作用,肿瘤细胞的大量溶解,胞内物质快速释放进入血液,超过了肝脏代谢和肾脏排泄的能力,使代谢产物蓄积而引起高尿酸血症和代谢性酸中毒等一系列代谢紊乱,进而导致严重的心律失常或急性肾功能衰竭而危及生命[7]。主要症状为高钾血症、高磷血症、高尿酸血症和低钙血症[2]。有研究[8]将TLS分为实验室指标型和临床型,实验室指标型是指细胞毒性治疗开始后的3天前或7天出现2项或以上的实验室指标异常(包括尿酸、钾、磷与钙);临床型表现为异常的实验室指标和1个或以上靶器官损害(包括肾脏、心脏和中枢神经系统)。TLS处理的基本原则是水化、碱化和利尿,纠正电解质紊乱并积极治疗肾功能衰竭。
神经毒性
神经毒性即CAR-T相关的脑病综合征(CRES)。研究[9]发现,CAR-T细胞治疗可引起表现多样的神经系统症状,如头痛、失语、谵妄、认知缺陷、运动障碍和癫痫发作等,一般情况下这种神经系统毒性可逆转,但严重时可引起脑水肿,导致患者死亡。CRES与CRS可同时发生,也可发生在CAR-T细胞输注后5~7天,通常持续2~4天,但也有可能持续数小时至数周。另有研究[5]显示,约10%的患者在接受CAR-T细胞治疗后的第3~4周发生癫痫或意识错乱的迟发性神经毒性。采用CAR-T治疗相关毒性(总分10分)评分系统[10]对神经毒性进行评估,包括定向力、注意力、语言和书写能力的评估,至少每8小时评估1次。总评分10分为认知功能正常,7~9分为1级CRES,3~6分为2级CRES,0~2分为3级CRES,患者处于危重状态和(或)反应迟钝而不能进行评估为4级CRES。同时评估患者是否具有颅内压增高、癫痫发作征象及吞咽能力受损等,并给予相应药物治疗。
总结
CAR-T细胞的问世及其临床应用是肿瘤治疗史上的一大进步。不过,尽管CAR-T细胞对血液系统肿瘤的疗效显著,但其治疗患者的细胞因子风暴和神经毒性发生率似偏高,准确评估、有效监测和早期识别并尽早干预毒性反应,有利于降低危及生命的并发症风险,以确保CAR-T疗法顺利开展,使患者能最大限度地从细胞免疫疗法中获益,取得良好的预期效果,并提高生活质量。
参考文献
[1] 郝贺,汪治宇.CAR-T细胞治疗肿瘤的脱靶效应及其预防策略[J].中国肿瘤生物治疗志,2017,24(3):317-322.
[2] 钱军,周俊东,邹志宏.细胞因子释放综合征的发生机制和防治策略[J].肿瘤研究与临床,2015,27(2):135-138.
[3] LEE D W,GARDNER R,PORTER D L,et al.Current con-cepts in the diagnosis and management of cytokine release syndrome[J].Blood,2014,124(2):188-195.
[4] 王琪,张坦,苏凤,等.细胞因子释放综合征的不良反应研究现状[J].中国临床药理学杂志,2018,34(7):906-909.
[5] SATTVA S N,SUDHAKAR T,PARTOW K,et al.Chimeric antigen receptor T-cell therapy-assessment and management of toxicities[J].J Clin Oncol,2018,1(15):47-62.
[6] HAY K A,HANAFI L A,LI D,et al.Kinetics and biomark- ers of severe cytokine release syndrome after CD19 chimeric antigen receptor modified T cell therapy [J].Blood,2017,130(21):2296-2306.
[7] 林才瑶,MUHAMMAD K,梁可莹,等.CAR-T疗法及其在肿瘤免疫治疗中的应用进展[J].中国细胞生物学学报,2018,40(3):412-427.
[8] CAIRO M S,BISHOP M.Tumour lysis syndrome:New ther-apeutic strategies and classifcation [J].British Journal of Haematology,2015,127(1):3-11.
[9] MEI H,JIANG H,WU Y,et al.Neurological toxicities and coagulation disorders in the cytokine release syndrome during CAR-T therapy[J].Br J Haematol,2018,181(5):6 89-692.
[10] NEELAPU S S,TUMMALA S,KEBRIAEI P,et al.Chimeric antigen receptor T-cell therapy assessment and management of toxicities[J].Nat Rev Clin Oncol,201 8(15):47-62.