



 有临
有临
 2023.02.02
2023.02.02
 4470
4470
近年来,真实世界研究(Real-World Study,RWS)的概念在医学界和制药工业界可谓炙手可热。2020年至今,以“真实世界研究”为主题的研究论文数量超过了2020年之前所有该类论文数量的总和。本文将简要介绍RWS的相关概念、发展历史、研究设计与执行中的关键点以及对RWS在中国未来发展的展望。
概念辨析——RWS、RWD、RWE,区别何在?
随着RWS概念的走红,各种相关概念如真实世界数据(Real-World Data,RWD)、真实世界证据(Real-World Evidence,RWE)等也逐渐走进临研人的视野,但由于真正经历过RWS工作的从业者在业内仍属于少数,人们对于各个概念之间的区隔和辨析目前仍然不够清晰。概念区分不明、错用、乱用的现象,即使在RWS发展最快的国家也仍然存在。2022年5月,FDA评审专家在《新英格兰医学杂志》发表文章《Real-World Evidence——Where Are We Now?》,进一步梳理了RWD和RWE在RWS框架下的概念,并介绍不同研究设计类型对RWD的依赖程度[1]。
RWD是指在真实世界环境下收集到的与研究对象健康有关的数据,RWE是指通过对RWD的研究,得出的与医疗产品的临床获益/风险相关的临床证据,而RWS则是收集RWD用并用真实世界分析方法得出RWE的研究过程。RWD、RWE和RWS三者的关系,用一个比喻来概括就是:RWD是原材料,RWE是最终产品,而RWS就是用原材料生产产品的整个过程。

RWS从何处来,向何处去
早在1993年,Kaplan NM教授在一篇前瞻性研究论文中就已经正式提出了RWS的概念,此后这种研究形式的理念逐渐在临床研究行业受到关注。但在工业界人士的一般印象中,RWS以及其关联概念RWD和RWE是相对新颖的,在2016年之后才出现在大家的视野中。究其原因,是因为2016年美国颁布了《21世纪治愈法案》,从此之后,与工业界休戚相关的要点——利用RWE扩大适应症的批准,得到了官方的正式背书。
两年后的2018年,FDA发布《Framework for FDA’s Real-World Evidence Program》,旨在更为细化地指导RWS的实施。2020年至2021年间,我国监管机构也积极跟进,先后推出了4个与RWS相关的指导原则,覆盖了药物研发、医疗器械、儿童药物和RWD使用的主题。
时至今日,在上市申请中使用了RWE并获得批准的案例逐渐积累。其中引起业界广泛关注和热议的是两个获批事件:FDA批准辉瑞Ibrance®男性乳腺癌适应症[2]和FDA批准安斯泰来Prograf®用于接受肺移植后预防器官排斥反应[3]。前者为业界人士植入了“RWS有可能用来扩展适应症”的真实感受,而后者则勾画了RWS了一个美好未来:在目标明确、设计良好、对照合理的研究中产生的RWE,能够作为批准的依据。
RWS画像——问题、方法、困难和结果的应用
与临研人所熟知的、以随机对照临床试验(RCT)为代表的临床研究相比,RWS的运行模式并没有本质上的不同。RWS与RCT一样,都需要找到临床问题、确立科学合理的研究设计和研究方案、收集数据、对数据进行管理和统计分析以及对结果进行解读评价。判断一个研究是RWS还是RCT的标准不是试验设计和研究方法,而是研究实施的场景。RWS所用的数据(也就是RWD)源自医疗机构、家庭和社区等“真实世界”中的诊疗发生场景,而非存在诸多严格限制的标准化试验环境。
RWS的开端是临床问题的确定。RCT要研究的通常是某种治疗手段对某个特定人群的有效性和安全性,也就是治疗性研究。而RWS的研究范围要广阔许多,包含病因、诊断、治疗、预后、临床预测以及药物经济学等研究问题。

RWS的研究问题确定后,就需要去解决RWD从哪里来的问题。对于我国来说,RWD的常见来源有:卫生信息系统(HIS)、医保系统、疾病登记系统、国家药品不良反应监测哨点联盟CASSA、自然人群队列数据库、组学相关数据库、死亡登记数据库、患者报告结局数据以及其他特殊数据源。这些数据又可以分为“一手”数据(Primary data)和“二手”数据(Secondary data)。“一手”数据是指真实世界中为了预先设定目的收集的数据,例如来自前瞻性观察性研究、干预性研究或患者报告的数据。而“二手”数据是真实世界中为了其他目的收集的数据,可以来自医保、电子健康记录、已存在的数据库、移动设备等等。
在RWS的设计和实施过程中,偏倚和混杂是需要特别审视的问题,在整个研究过程中都需要时刻关注。“真实世界”中的“真实”,意味着数据来源广泛、多样、更贴近现实环境,研究结论比严格试验条件下得出的结论更具有可外推性,但也同样意味着数据质量会良莠不齐。如何将这些数据进行筛选和治理以便让研究对数据的使用和分析达到科学标准,是RWS研究实施过程中最关键的问题。也就是说,在利用“真实”的优势的同时,又要努力减少“真实”的副作用。获得RWD后,首先要对数据的适用性进行评估,确保其能够满足研究的最终目的。其次,需要结合研究设计的要素和统计分析方法的要求对RWD数据进行治理,加强数据质量。
对于制药工业界来说,数据的价值在于产生证据,证据的价值在于指导正确决策。RWS的成功实施,产生了高质量的RWE,最终还是要落实到支持监管决策上,才能发挥出了RWE最大的价值。
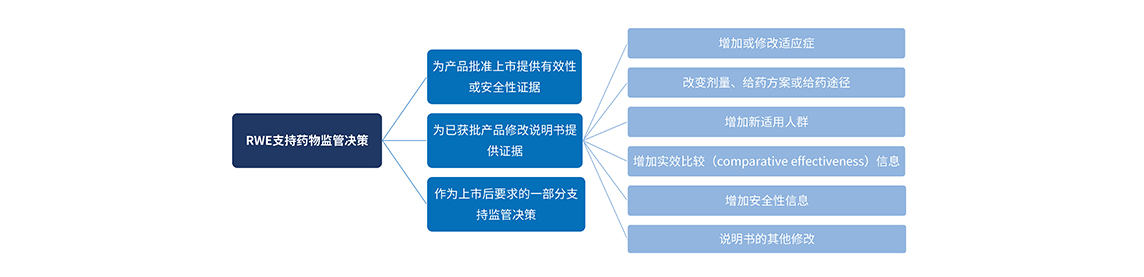
RWS落地中国,还缺什么?
以患者为中心、以临床价值为导向,是我国未来医疗服务发展的基本纲领。传统的RCT无疑具有很高的证据等级,但因为研究条件严格,所能覆盖的人群较小,不足以解决广泛而复杂的未被满足的临床需求。我国加入ICH后,临床研究的理念快速与国际接轨,药监机构逐渐认可RWE在解决临床问题、确定创新治疗方法方面的重要性。可以预见,未来RWS将会具有越来越重要的地位。
数据的数量和质量是RWS的“生命线”,是RWS能否存在和发展的前提。然而,中国创新药临床研发启动时间晚,整体欠缺经验,基础设施发展不完善,国内从业者大多缺乏对药品全生命周期管理的意识,主动开展持续的上市后监测也并不积极。此外,国内RWD的主要数据源头上,由于各部门既往对RWD价值的认知严重不足,致使存在着数据质量极低、数据库建设和管理不足以及数据库之间彼此隔绝不互通等问题,这对于需要依靠长期、完整、大量数据为基础的真实世界证据挖掘来说,无疑是困难重重的。
意识先于行动,思想引导实践。随着医药创新事业在我国的蓬勃发展,越来越多的从业者和监管人员将会逐渐培养起优秀的数据管理意识和数据挖掘素养。而计算机科学和信息技术(如机器学习、图像识别、云计算、区块链等新技术)的发展和成熟,可以快速帮助各种临床数据实现自动/半自动化采集、结构化存储和脱敏加密传输,使多维度数据整合及一体化管理成为可能。这些都将为RWS的实施打破过去的阻碍,为RWS在我国开花结果增添动力。
参考文献
[1]Concato J, Corrigan-Curay J. Real-World Evidence - Where Are We Now?. N Engl J Med. 2022;386(18):1680-1682. doi:10.1056/NEJMp2200089
[2]Wedam S, Fashoyin-Aje L, Bloomquist E, et al. FDA Approval Summary: Palbociclib for Male Patients with Metastatic Breast Cancer. Clin Cancer Res. 2020;26(6):1208-1212. doi:10.1158/1078-0432.CCR-19-2580
[3]https://www.fda.gov/drugs/news-events-human-drugs/fda-approves-new-use-transplant-drug-based-real-world-evidence