



 有临
有临
 2023.04.07
2023.04.07
 3340
3340
表皮生长因子受体(简称为EGFR、ErbB-1或HER1)是受体酪氨酸激酶(RTK)超家族的一员,由外显子边界和相关的细胞外、跨膜和细胞内蛋白质结构域组成,EGFR参与多种信号通路并调节多种细胞功能。EGFR与配体结合后发生二聚化,激活细胞内酪氨酸激酶结构域和自磷酸化,启动Ras/RAF/MEK、转录激活因子(STAT)、PI3K/AKT/mTOR等下游信号通路,参与调节细胞增殖、迁移、存活和抗凋亡反应,在许多实体肿瘤中存在EGFR的高表达或异常表达。因此,EGFR已成为抗肿瘤药物设计和开发的一个很有前途的靶点 [1](图1)。
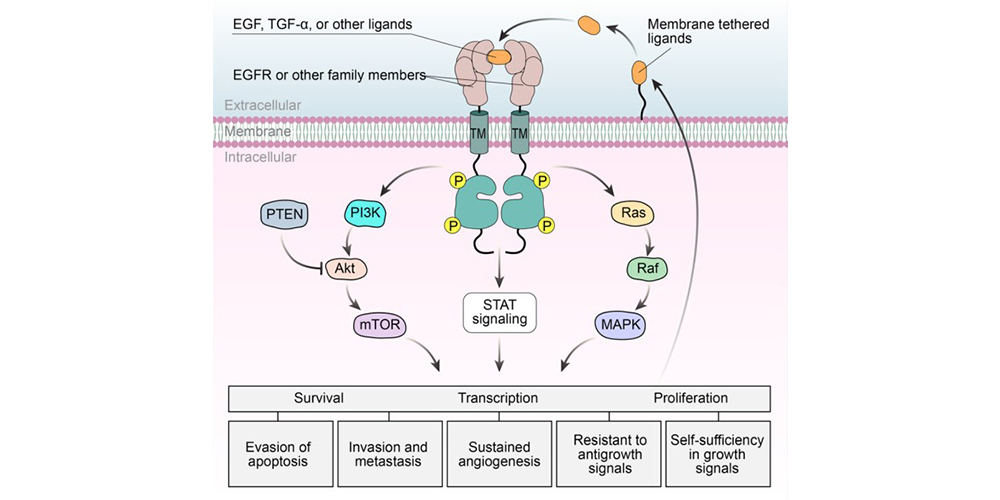
图1 EGFR的结构和功能
01 EGFR-TKI的发展历程
目前获批的EGFR-TKI已历经三代靶向药物,第四代也已进入临床研究。1978年,首次有学者提出将EGFR作为癌症的潜在治疗靶点;2003年,首个EGFR-TKI吉非替尼获FDA批准上市;2005年,与第一代药物耐药相关的T790M突变被报道;2013年,首个第二代EGFR-TKI阿法替尼获FDA批准上市;2015年,三代EGFR-TKI奥希替尼在美国获批,用于第一、二代EGFR-TKI治疗失败的EGFR突变晚期NSCLC。同时,与第三代耐药相关的C797S突变被发现,三代EGFR-TKI的代表药物、抑制剂类型、作用靶点和临床疗效总结如表1所示。2021年,第四代EGFR-TKI 代表药物BLU-945进入临床研究,如图2[1] 。第四代EGFR-TKI目前处于临床早期研发阶段,主要研发用于三代EGFR-TKI耐药且携带C797S突变的患者。全球范围内目前尚无四代EGFR-TKI获批上市,进入临床阶段的代表药物有BLU-945和BBT-176等。
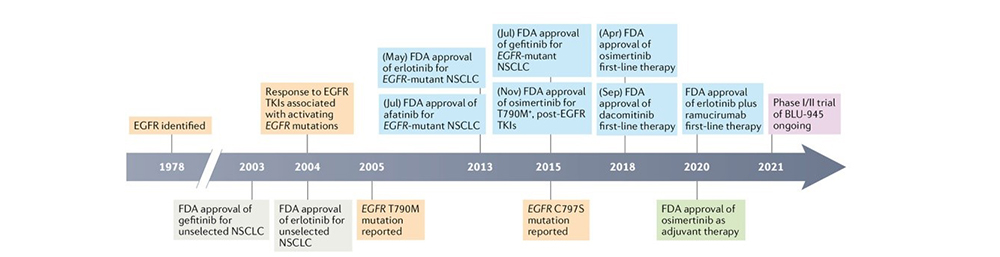
图2 EGFR突变基因的发展和药物开发时间表
表1 三代EGFR-TKI对比

02 EGFR-TKI国内上市情况
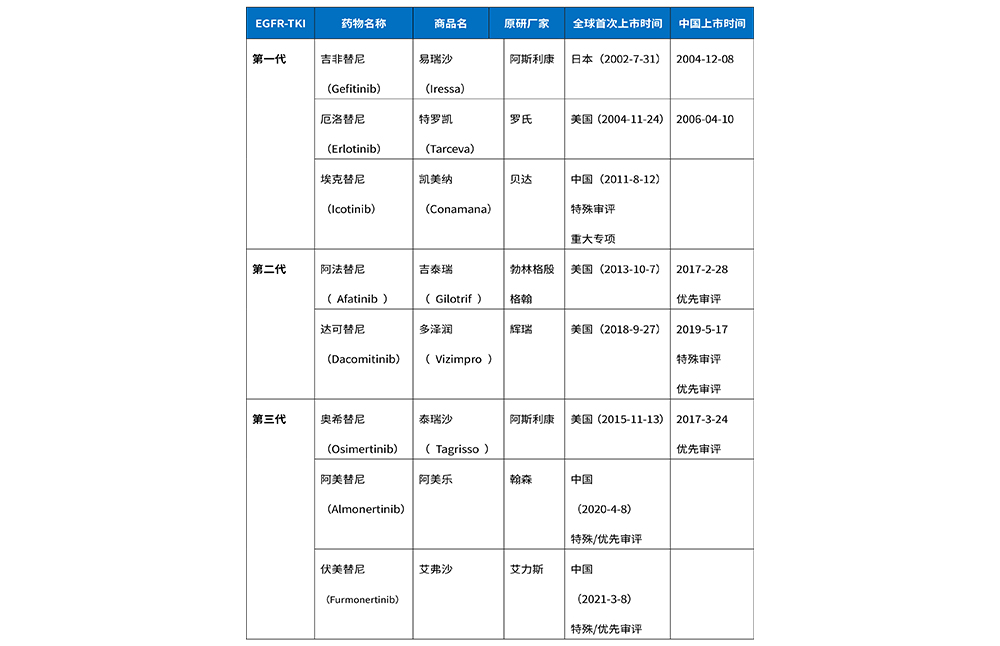
在中国EGFR-TKI上市药物已达到8个,吉非替尼是中国首个获批上市的药物,于2004年12月在中国上市。奥希替尼为首个获得批准用于EGFR T790M突变NSCLC患者临床应用的第三代EGFR-TKI,于2017年3月在中国获批,用于一二代耐药后存在T790M突变的晚期NSCLC患者;于2019年8月获批一线治疗EGFR敏感突变阳性晚期NSCLC的适应症。2021年4月获批用于具有EGFR敏感突变的NSCLC成人患者肿瘤切除术后的辅助治疗。埃克替尼、阿美替尼和伏美替尼为国内获批上市的本土EGFR抑制剂。详细上市情况见表2。
表2 中国已上市的EGFR-TKI药物基础信息对比
03 第三代EGFR-TKI耐药机制研究
EGFR-TKI的快速发展彻底改变了EGFR突变NSCLC的治疗模式,提高了该人群的生存率和生活质量。然而,尽管EGFR-TKI治疗后的患者生存期较长,不良事件发生率较低,但无论采用何种治疗方案,大多数患者最终都对EGFR-TKI产生耐药性。获得性耐药机制大致分为EGFR依赖机制(靶内)和EGFR非依赖机制(脱靶)。早期EGFR-TKI和第三代EGFR-TKI的靶内和脱靶耐药机制的相对发生率不同,患者在早期EGFR-TKI进展时主要出现靶内耐药机制,其中T790M约占50%。然而,在接受奥希替尼治疗的患者中,仅有10~20%发生靶内耐药[5],详情如下图3所示。C797X突变(主要是C797S)已成为最常见的EGFR依赖性奥希替尼的耐药机制,发生率取决于不同的治疗环境。在AURA3试验中[6],奥希替尼二线治疗中疾病进展时C797X突变的发生率为15%,而在FLAURA试验中[7],一线患者在疾病进展时仅检测到7%的C797X突变,在其他研究中,C797X突变的患病率从0到29%不等。值得注意的是,在某些研究中,大约50%的EGFR T790M阳性NSCLC患者在接受奥希替尼治疗后可能会出现T790M丢失[8]。与EGFR依赖性耐药机制相比,EGFR非依赖性机制在奥希替尼耐药中更为显著和频繁,这可能是由于奥希替尼具有更好的靶向抑制作用。EGFR非依赖性耐药机制主要包括MET扩增、HER2扩增、其他酪氨酸激酶受体的改变、致癌基因融合、信号通路的改变、细胞周期基因改变及组织学转化。

图3 奥希替尼的耐药机制
04 奥希替尼耐药的治疗策略
基于已知的耐药机制,潜在的治疗方案包括靶向治疗(靶内和脱靶)、铂类化疗和免疫治疗。奥希替尼耐药后的治疗步骤如图4所示[5]。在奥希替尼治疗前,患者应通过组织活检和/或液体活检,以确认是否存在EGFR突变。当患者服用奥希替尼进展时,应进行组织活检和/或液体活检,以确定对奥希替尼耐药的机制,以指导治疗。如果目前存在有效的治疗方法,将应用相应的治疗方案;在缺乏有效靶点的情况下,应考虑临床前研究和临床试验,以获取有价值的证据,进一步探索可行的治疗策略。
针对靶内耐药机制,由于NSCLC患者在奥希替尼治疗过程中可能发生T790M缺失并获得第三次突变,因此在奥希替尼治疗进展后,利用早期EGFR-TKI重新治疗似乎是可行的治疗方法。阿法替尼单药治疗对奥希替尼产生耐药的Ex19del/G724S突变的患者,取得显著疗效[11]。但是,如前文所述,有学者认为在大多数情况下,T790M的缺失与替代脱靶耐药机制的出现有关,导致早期EGFR-TKI治疗失败。因此,重新使用早期EGFR-TKI可能并不总是有效的。在存在T790M和C797S复合突变的情况下,尤其是C797S和T790M突变在不同的染色体时(反式),第一代和第三代EGFR-TKI的联合治疗可使患者获益;当位于同一染色体(顺式)时,单独或联合使用EGFR-TKI均无效,联合使用brigatinib(一种ALK和EGFR双重抑制剂)和西妥昔单抗(抗EGFR抗体)治疗分别在临床前研究和病例报告中显示出良好的疗效。第四代EGFR-TKI在远离酪氨酸激酶结构域的位点与EGFR结合,绕过C797S介导的耐药机制,有望克服C797S诱导的奥希替尼耐药。
对于脱靶耐药机制的治疗的策略主要是奥希替尼联合靶点抑制剂如MET抑制剂、FGFR抑制剂和ALX抑制剂等。
虽然已经确定了奥西替尼靶内和脱靶耐药机制,但30~50%的耐药机制仍然未知。对于没有靶向耐药机制的患者,靶向治疗是不可行的,而以铂类为基础的双重化疗方案是缺乏靶向突变的晚期NSCLC患者的一线治疗方法,但在PD-L1表达≥50%的患者中,免疫检查点抑制剂是优先选择。研究显示VEGF通路与EGFR-TKI耐药有关[12],奥希替尼联合贝伐单抗治疗EGFR突变肺癌患者取得了良好的疗效和较长的生存期。其他的免疫治疗策略包括EGFR单抗、靶向EGFR和MET的双抗以及HER2 ADC药物,也是奥希替尼耐药后可选择的治疗方法。

图4 奥希替尼耐药后的治疗策略
05 第四代EGFR-TKI研发现状
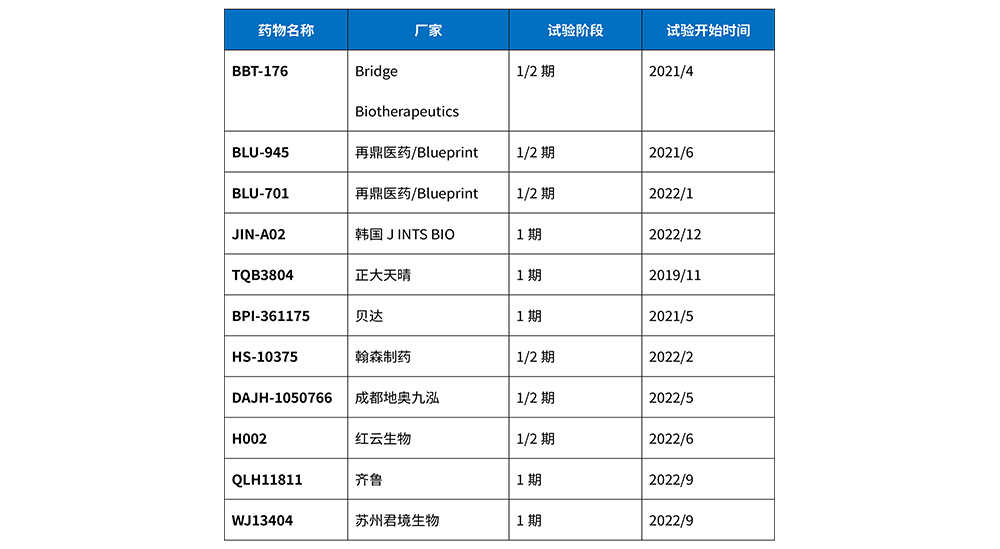
第四代EGFR-TKI有望克服三代EGFR-TKI耐药且携带C797S突变的患者,而被寄予厚望。多数四代药物对单突变体(19del或L858R)、双突变体(19del /T790或L858R/T790M)、三重突变体(19del /T790M/C797S或L858R/T790M/C797S)均具有较高的抑制活性。目前,全球尚无四代EGFR-TKI获批上市,但已有不少药企投入到四代EGFR-TKI的开发中,详见表3。目前第四代EGFR-TKI均处于临床1/2期的早期研发阶段,只有BLU-945和BBT-176公布了部分试验结果。国内研发的H002、TQB3804和DAJH-1050766等四代EGFR抑制剂都在进行临床实验,期待这些药物能取得良好的疗效和安全性的结果,解决耐药难题,提高患者的生存期,进一步实现精准医疗。
表3 第四代EGFR-TKI研发现状
参考文献
[1]. Kunyu Shi, Guan Wang,et a1.Emerging strategies to overcome resistance to third-generation EGFR inhibitors. J Hematol Oncol. 2022; 15: 94.
[2]. Julian A. Marin-Acevedo, Bruna Pellini, et a1.Treatment Strategies for Non-Small Cell Lung Cancer with Common EGFR Mutations: A Review of the History of EGFR TKIs Approval and Emerging Data. Cancers 2023, 15(3), 629.
[3]. Kuiper JL, Heideman DA, Thunnissen E, Paul MA, van Wijk AW, Postmus PE, Smit EF. Incidence of T790M mutation in (sequential) rebiopsies in EGFR-mutated NSCLC-patients. Lung Cancer. 2014;85(1):19–24.
[4]. Carlisle JW, Ramalingam SS. Role of osimertinib in the treatment of EGFR-mutation positive non-small-cell lung cancer. Future Oncol. 2019;15(8):805–16.
[5]. Kai Fu, Fachao Xie, et a1.Therapeutic strategies for EGFR-mutated non-small cell lung cancer patients with osimertinib resistance.Journal of Hematology & Oncology (2022) 15:173.
[6]. Papadimitrakopoulou VA, Wu YL, Han JY, Ahn MJ, Ramalingam SS, John T, Okamoto I, Yang JCH, Bulusu KC, Laus G, et al. LBA51—analysis of resistance mechanisms to osimertinib in patients with EGFR T790M advanced NSCLC from the AURA3 study. Ann Oncol. 2018;29:viii741.
[7]. Ramalingam SS, Cheng Y, Zhou C, Ohe Y, Imamura F, Cho BC, Lin MC, Majem M, Shah R, Rukazenkov Y, et al. LBA50—mechanisms of acquired resistance to first-line osimertinib: preliminary data from the phase III FLAURA study. Ann Oncol. 2018;29:viii740.
[8]. Mu Y, Hao X, Xing P, Hu X, Wang Y, Li T, Zhang J, Xu Z, Li J. Acquired resistance to osimertinib in patients with non-small-cell lung cancer: mechanisms and clinical outcomes. J Cancer Res Clin Oncol. 2020;146(9):2427–33.
[9]. Enrico DH, Lacroix L, Rouleau E, Scoazec JY, Loriot Y, Tselikas L, Jovelet C, Planchard D, Gazzah A, Mezquita L, et al. 1526P—Multiple synchronous mechanisms may contribute to osimertinib resistance in non-small cell lung cancer (NSCLC) patients: Insights of the MATCH-R study. Ann Oncol. 2019;30: v627.
[10]. Oxnard GR, Hu Y, Mileham KF, Husain H, Costa DB, Tracy P, Feeney N, Sholl LM, Dahlberg SE, Redig AJ, et al. Assessment of resistance mechanisms and clinical implications in patients with EGFR T790M-positive lung cancer and acquired resistance to osimertinib. JAMA Oncol. 2018;4(11):1527–34.
[11]. Fang W, Huang Y, Gan J, Zheng Q, Zhang L. Emergence of EGFR G724S after progression on osimertinib responded to afatinib monotherapy. J Thorac Oncol. 2020;15(3):e36–7.
[12]. Zhou Q, Xu CR, Cheng Y, Liu YP, Chen GY, Cui JW, Yang N, Song Y, Li XL, Lu S, et al. Bevacizumab plus erlotinib in Chinese patients with untreated, EGFR-mutated, advanced NSCLC (ARTEMIS-CTONG1509): a multicenter phase 3 study. Cancer Cell. 2021;39(9):1279-1291.e1273.