



 有临
有临
 2023.06.02
2023.06.02
 1877
1877
EGFR ex20ins介绍
EGFR基因由7号染色体上的28个外显子组成,其中20外显子负责转录E762 -K823位置的氨基酸,其中包括由E762-M766氨基酸构成的C-螺旋以及由A767-V774氨基酸构成的环。20外显子中最常见的插入突变位点为D770_N771insX,其次是V769_D770insX。763_764insFQEA是目前发现的20外显子插入突变中的敏感突变,约占EGFR ex20ins的6%,是对一代EGFR-TKIs都敏感的突变。
EGFR基因突变占全部NSCLC的32%-38%。第19外显子缺失突变和21外显子L858R突变约占所有EGFR基因突变的90%,而ex20ins仅次于前两者,约占4%-12%。ex20ins对一二代EGFR-TKIs不敏感,是EGFR基因突变中最常见的非敏感突变。ex20ins并未改变ATP结合口袋,而是在c-螺旋的末端形成的残基末端激活了酶构象,从结构来看,EGFR 20外显子插入突变体与吉非替尼的亲和力与野生型相似,这可能是携带EGFR ex20ins患者对一二代EGFR-TKIs不敏感的原因。
EGFR ex20ins靶向布局情况
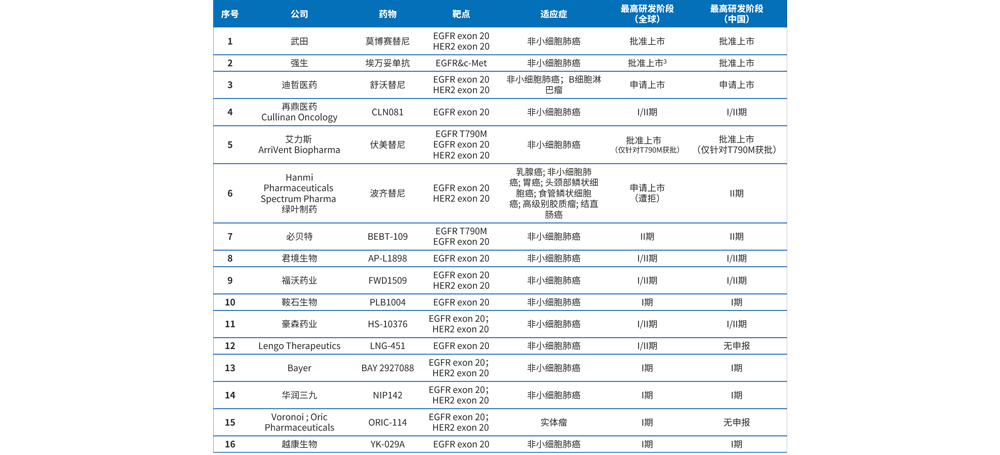
目前,EGFR ex20ins靶向药中已上市有2个,分别为武田的莫博赛替尼和强生的埃万妥单抗,莫博赛替尼分别于2021年9月15日和2023年1月11日获FDA和NMPA批准用于含铂化疗期间或之后进展EGFR ex20ins的NSCLC。埃万妥单抗于2021年5月获FDA批准用于含铂化疗期间或之后进展EGFR ex20ins的NSCLC,并于2021年12月10日获NMPA批准用于含铂治疗后进展EGFR ex20ins的NSCLC。申请上市有1个,为迪哲医药的舒沃替尼,于2022年1月31日获FDA突破性疗法认证,并于2023年1月10日获NMPA受理并优先审评。EGFR ex20ins靶向药布局情况详见表1。
表1 EGFR ex20ins靶向药布局情况
EGFR ex20ins靶向药研究结果汇总
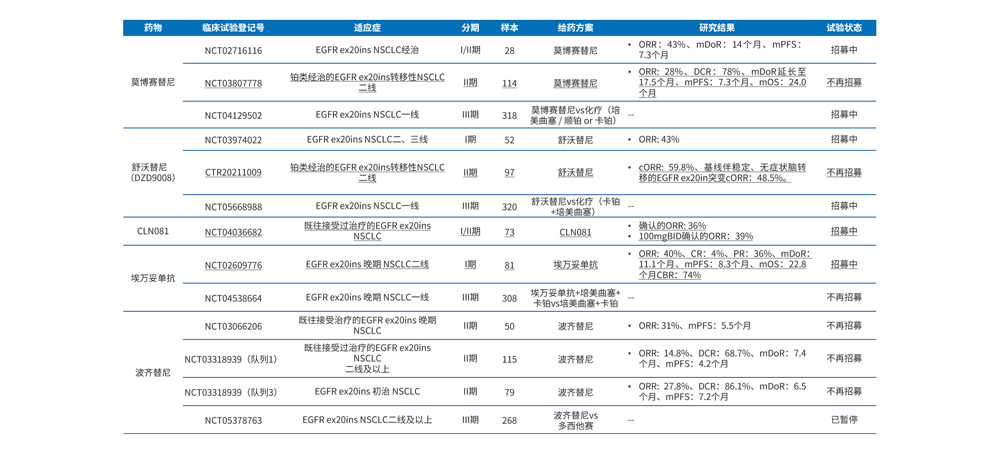
目前,EGFR ex20ins靶向药疗效显示,已上市的莫博赛替尼和埃万妥单抗的ORR分别为28%(95% CI, 20%-37%)和40%(95%CI,29%~51%)、而研发较快的舒沃替尼和CLN081的ORR分别为59.8%和36%、但波奇替尼的ORR仅为14.8%,详见表2。EGFR ex20ins靶向药安全性显示,最常见的毒副反应为消化道毒性和皮肤毒性,除此之外,心肺毒性如心力衰竭和间质性肺炎需要重点关注。
表2 EGFR ex20ins靶向药研究结果汇总
EGFR ex20ins靶向药临床开发策略
基于已获批和在研的EGFR ex20ins靶向药开发路径及法规要求,EGFR ex20ins靶向药可考虑关键单臂II期附条件上市。
人群选择:人群可选择含铂化疗期间或之后进展EGFR ex20ins NSCLC。
竞品考虑:目前获批上市的莫博赛替尼关键单臂II期ORR 95%CI的下限为20%、埃万妥单抗为29%、舒沃替尼可能更高,一旦舒沃替尼上市,可能会显著拉高关键单臂II期ORR 95%CI的下限。
申报策略考虑:开展关键单臂II期前需与CDE沟通单臂Ⅱ期ORR 95%CI的下限,由统计师计算样本量,并考虑同步或稍晚开展Ⅲ期RCT研究(一线),因为根据《单臂临床试验用于支持抗肿瘤药上市申请的适用性技术指导原则》(2023.03),①当申请人计划以SAT作为关键研究时,即可以开始对后续的确证性研究进行规划,鼓励申请人及早与监管机构就确证性研究计划、试验设计进行沟通交流。②原则上,申请人应在附条件上市申请获批前,启动确证性临床试验(以开始入组受试者判定试验“启动”)确证性临床试验一般情况下应该采用RCT设计,通常在与SAT研究相同(同一个治疗线)人群中,或者在SAT研究人群的前序治疗线人群中开展。
参考文献:
[1] Riely G J , Neal J W , Camidge D R , et al. Activity and Safety of Mobocertinib (TAK-788) in Previously Treated Non-Small Cell Lung Cancer With EGFR Exon 20 Insertion Mutations From a Phase 1/2 Trial[J]. Cancer discovery:candisc.1598.2020.
[2] Zhou C , Ramalingam S S , Kim T M , et al. Treatment Outcomes and Safety of Mobocertinib in Platinum-Pretreated Patients With EGFR Exon 20 Insertion-Positive Metastatic Non-Small Cell Lung Cancer: A Phase 1/2 Open-label Nonrandomized Clinical Trial[J]. JAMA oncology, 2021, 7(12):e214761.
[3] Park K , Haura E B , Leighl N B , et al. Amivantamab in EGFR exon 20 insertion-mutated non-small-cell lung cancer progressing on platinum chemotherapy: initial results from the CHRYSALIS phase I study[J]. Wolters Kluwer Health, 2021(30).
[4] Cho B C , Felip E , Hayashi H , et al. MARIPOSA: phase 3 study of first-line amivantamab+lazertinib versus osimertinib in EGFR-mutant non-small-cell lung cancer[J]. Future oncology (London, England), 2022, 18(6):639-647.
[5] 周文盛, 张伟, 韩宝惠. EGFR基因20外显子插入突变在非小细胞肺癌的研究及其进展[J]. 中国肺癌杂志, 2020, 23(2):9.
[6] 单臂临床试验用于支持抗肿瘤药上市申请的适用性技术指导原则,2023年3月.