



 有临
有临
 2023.07.28
2023.07.28
 2064
2064
细胞疗法概述
近年来,细胞治疗研究成为了全球生物医药领域的一股热潮。如果说二十世纪是药物治疗的时代,那么二十一世纪就是细胞治疗的时代。
细胞治疗是指采用生物工程的方法获取具有特定功能的细胞,并通过体外扩增、特殊培养等处理后再回输到患者体内,使这些细胞具有增强免疫、杀死病原体和肿瘤细胞等功能,从而达到治疗疾病的目的。主要的细胞治疗方式包括免疫细胞疗法和干细胞疗法。
免疫细胞疗法,也称过继性细胞疗法,包括CAR-T、CAR-NK、TCR-T、TIL、LAK、CIK、NK、DC等,适应症涉及肿瘤、感染和自身免疫性疾病等领域。
表1 免疫细胞疗法分类及细胞来源

干细胞疗法是一种再生医学,通过减少炎症和调节免疫系统来修复体内受损的细胞。干细胞主要包括成体干细胞、胚胎干细胞及诱导的多能性干细胞。目前国内外开展的干细胞(排除造血干细胞)临床研究涉及骨关节疾病、肝硬化、移植物宿主排斥反应、脊髓损伤及退行性神经系统疾病等。
中国细胞治疗监管体系
中国早在上世纪90年代便开始开展细胞治疗方面的基础研究和临床试验,但当时细胞治疗相关的监管政策与法规相对滞后。2017年以来,我国在细胞治疗方面政策频出,预示着我们进入了细胞治疗规范化发展阶段,也反映出国家层面对细胞治疗技术发展的推动以及临床转化的关注。
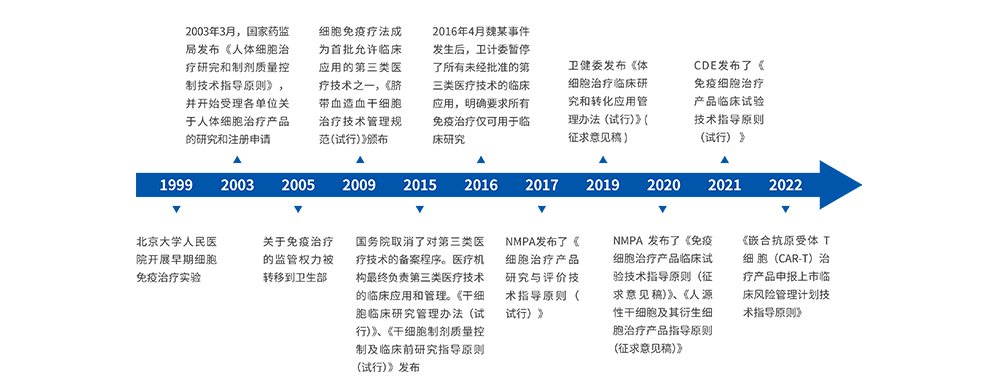
图1 中国细胞治疗关键政策法规历程
今年CDE又发布了《人源干细胞产品药学研究与评价技术指导原则(试行)》和《人源性干细胞及其衍生细胞治疗产品临床试验技术指导原则(试行)》。为了助力临床研发顺利推进,提高沟通交流效率,7月25日CDE推出了《细胞和基因治疗产品临床相关沟通交流技术指导原则(征求意见稿)》。
美国细胞治疗监管体系
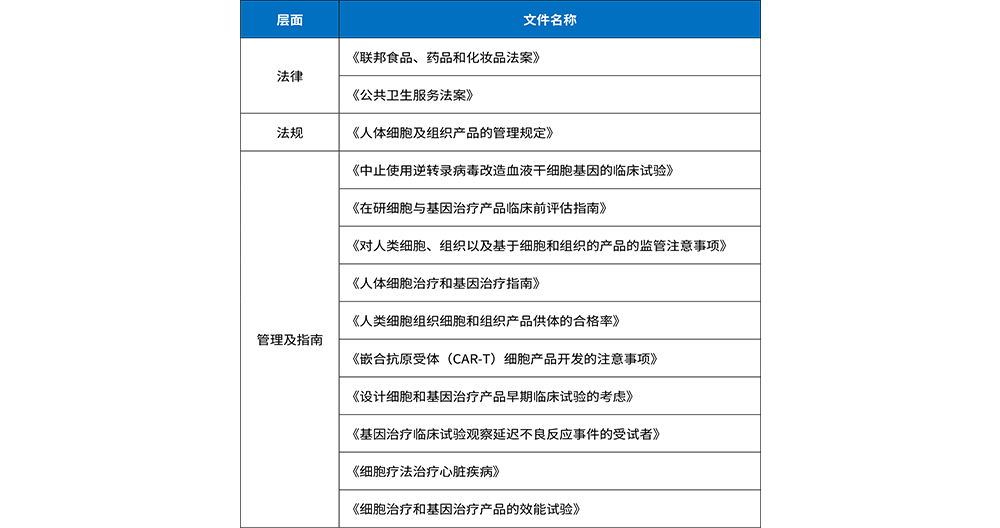
对于细胞治疗的监管,美国已进入规范发展阶段,形成了由法律、法规、管理制度与指南三部分组成的相对完善的监管体系。从非临床研究到临床研究都发布了相关的指导原则,对某些疾病的细胞治疗也单独发布了指导原则,其中既有对行业的指导原则,也有对FDA审评人员的指南。这对于我国细胞治疗产品监管体系发展,有诸多可借鉴之处。
细胞治疗属于生物制品范畴,由FDA的生物制品评估和研究中心(CBER)负责审评监管,基于细胞产品的风险高低分为高风险类和低风险类进行管理。其中,高风险的细胞产品(PHS第351条所规定的产品)必须经过FDA批准后方可进入临床试验,并在证明其安全、有效和质量后,经FDA批准才能上市销售。
表2 美国细胞治疗产品主要监管法律法规与指南
细胞治疗产品作为一种特殊的药品,需要根据不同产品的特性,制定相应的临床开发计划、临床试验方案和风险管理计划等。
我国新法规和指南日渐重视细胞疗法,将细胞治疗产品纳入药品监管的转变,更助力该领域长足发展。
参考资料:
[1] Evan W Weber, et al. The Emerging Landscape of Immune Cell Therapies. Cell, 2020 Apr 2, 181(1): 46-62.
[2] 《细胞治疗行业:中国细胞治疗产业发展白皮书》2021
[3] 高建超, 韦薇, 张旻, 等. 细胞和基因治疗产品监管科学研究进展和展望[J]. 中国新药杂志, 2022, 31(2): 105-108.
[4] http://www.cde.org.cn/
[5] https://www.fda.gov/