



 有临
有临
 2024.04.19
2024.04.19
 454
454
细胞和基因疗法(cellular and gene therapy, CGT),引领生物制药的新一轮浪潮。随着技术进步和产业发展,各国监管体系和评价方法不断完善。了解不同的监管要求、评价体系、技术标准、转化难点,总结经验和教训,有助于推演预期效果,降低潜在风险,提高研发效率。
本文侧重于介绍以上市为目的,按照药品进行监管的CGT法规现状。

各国对细胞治疗和基因治疗产品的概念定义侧重点各有不同。可以从作用原理、来源、人工操作方法、临床适用范围等方面进行界定。
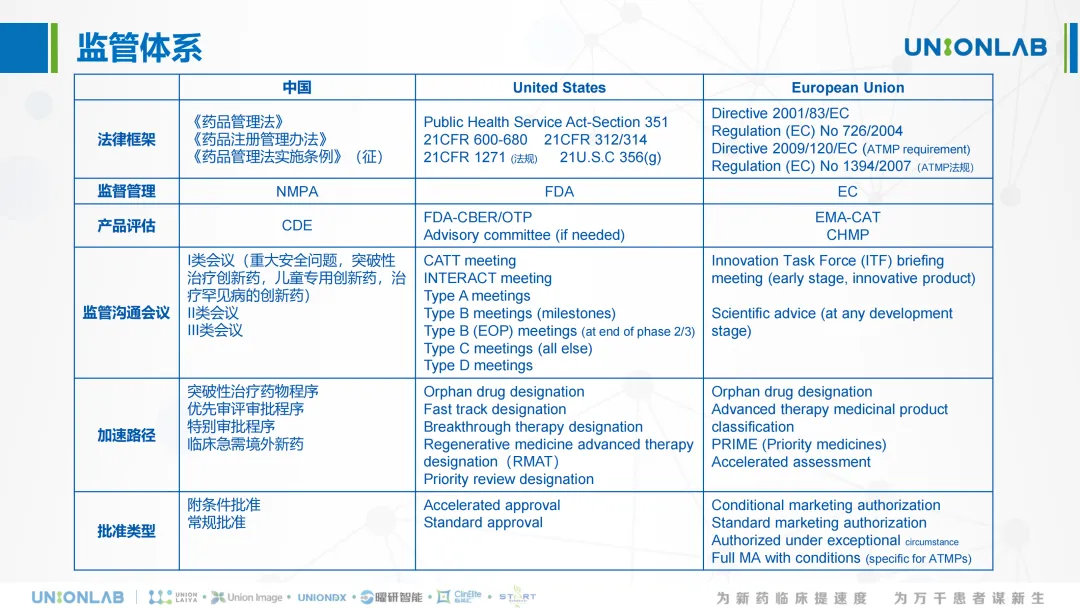
各监管机构陆续推出支持鼓励政策,优化沟通交流内容/方式、加快上市注册程序等,旨在加速未满足临床需求的药物开发。如我国不断优化各类沟通交流指导原则及资料要求,逐步调整加快上市注册程序纳入标准;FDA成立治疗性产品办公室(Office of Therapeutic Products,OTP),旨在加快CGT领域的监管审评;FDA的INTERACT meeting(INitial Targeted Engagement for Regulatory Advice on CBER producTs, INTERACT)及EMA的ITF briefing meeting(Innovation Task Force, ITF创新事物小组),鼓励申请人和监管机构进行早期对话。针对CGT产品,FDA的再生医学先进疗法认定(RMAT designation)及EMA的先进疗法分类(ATMP classification),均鼓励与监管进行更早期更频繁的沟通交流;EMA的PRIME,入围的候选药物临床研究程度更低而创新性更高,对ATMP相对友好。
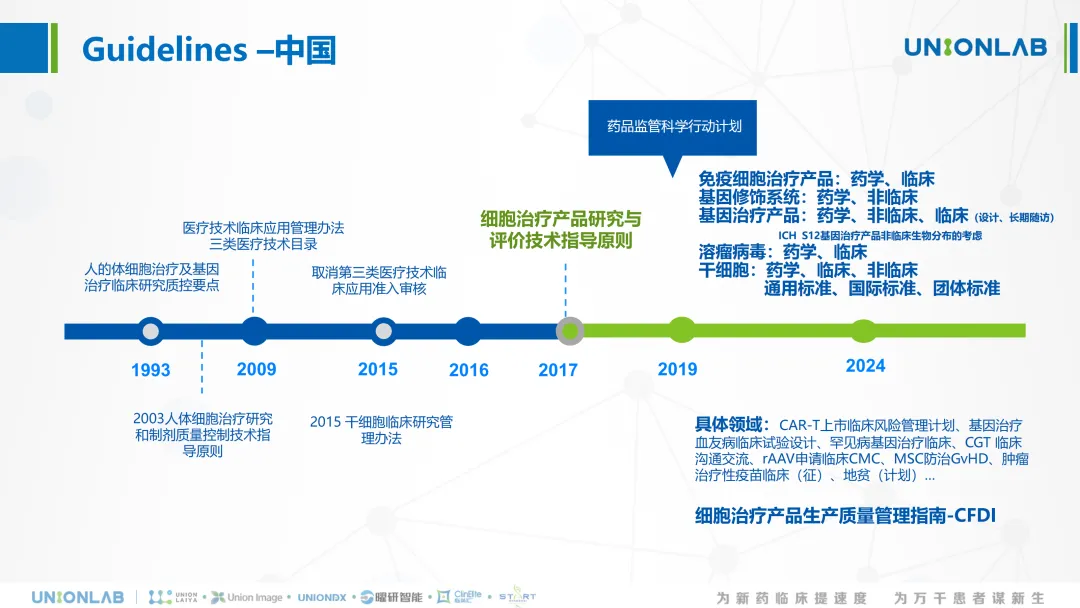
目前,我国对细胞和基因治疗按照医疗技术和药品注册进行“类双轨制”监管。
细胞和基因治疗最初于1993年进入我国监管机构的视野,经历1993年至2015年监管较为宽松的自由发展阶段,2016年受挫严格调整阶段,及2017年至今的全面有序规范发展阶段。2017年CDE发布《细胞治疗产品研究与评价技术指导原则》,各部委和地方政府出台相关文件来规范和引导产业发展,标志着我国CGT走上正规发展的道路。2019 年,国家药品监督管理局启动中国药品监管科学行动计划,两批重点研究项目陆续纳入了“细胞和基因治疗产品技术评价与监管体系研究”及“干细胞和基因治疗产品评价体系及方法研究”,以适应需求。目前,各细分领域的指导原则基本成型。


FDA、EMA对CGT监管指南从早期的通用要求,逐渐细分到针对特定疾病或特类产品。不同细胞或基因治疗产品的差异很大,随着技术发展及共识提高,CGT产品的法规将会针对不同种类逐渐细化和明晰。
未来展望和挑战
l 基于CGT产品复杂性及多样性,监管新工具、新标准、新方法将会不断转化。期待我国更丰富的多学科专家咨询委员会,及更早期的监管介入。
l 关注不断凝聚、积累更新的监管共识、审评实践、行业共识及问答,如CDE细胞治疗产品申报临床试验药学研究问题与解答,FDA CBER OTP Town hall等,有助于我们从业者提高认知。
l CGT产品的技术特异性,可能会给患者带来潜在安全性风险。要求从业人员持严谨态度,提前识别并严控各类风险。如生产用原材料的合规评价和风险评估、外源因子安全性评估、生物学活性的研究与方法开发、技术转移及各类变更评估、上市后安全性监测等。
l 在确保安全及现有科学认知的基础上,各监管机构显示出一定的审评和监管策略的灵活性。基于产品及适应症的加速审批潜力,与监管进行早期及关键节点的高效沟通交流尤为重要。
参考文献:
1. https://www.nmpa.gov.cn/index.html
2. https://www.cde.org.cn/
3. https://www.fda.gov/
4. https://www.ema.europa.eu/en/homepage
5. https://commission.europa.eu/index_en