



 有临
有临
 2024.09.03
2024.09.03
 995
995

二十四年前(2000年),CDISC(the Clinical Data Interchange Standards Consortium,临床数据交换标准协会)由32家跨国公司的创始,自此造就了一个全球性非营利组织,以期实现临床及临床前数据的电子获取、交换、提交和归档的标准化。
二十年前(2004年),FDA接受使用CDISC的SDTM(Study Data Tabulation Model,研究数据制表模型)进行电子递交作为推荐标准。四年后(2008年),CDASH(Clinical Data Acquisition Standards Harmonization,临床数据获取协调标准)v1.0正式发布。CDASH基于SDTM而建立,标志着从数据递交端回溯到数据获取端,临床试验数据采集的基本标准获得了定义,CRF(Case Report Form,病例报告表)的设计拥有了最重要也最为详细的标准与指导。
从CDASH诞生起,基于CDASH标准的CRF企业标准模板(以下简称“CRF模板”)成为了行业内含有数据管理业务的公司开展各项工作的“基础建设”之一。因为临床试验中的CRF设计的质量对于所采集到的试验数据的质量无疑具有决定性意义,而CRF设计的质量和效率除了与数据管理的流程以及人员的能力极为相关以外,与各企业的CRF模板的质量也有莫大的相关性。
但CRF模板对于业内公司而言,并非必须开发和拥有的工具。GCDMP(Good Clinical Data Management Practices,临床数据质量管理规范)将“建立和维护一个包含标准表格和相关逻辑核查(CRF、CRF 填写指南、受试者日记等)的库”作为“数据采集工具的设计和开发”的最佳实践而非最低标准来描述。CRF模板的这种非必须性一定程度上使人们忽视了对其进行评价的必要性,且业内也并没有评价此类开发的普遍的标准。那么可以从哪些维度出发进行基于CDASH标准的CRF模板评价?怎样高效利用和持续优化模
板?以下提供若干参考:
01. 数据采集的完整度
最新发布于2023年9月28日的CDASHIG(Clinical Data Acquisition Standards Harmonization Implementation Guide for Human Clinical Trials)v2.3 描述了包括2个特殊用途域和干预类6个、事件类7个、发现类25个、关于事件和干预的发现类2个,以及关联人员域,总共43个数据域(Domain)。而其中每一个Domain的说明表(Specification)中,每一行都围绕一个字段进行多项说明,包括这个字
段的变量名、变量标签、定义、提问文本、提示、数据格式等等。其中有一列CDASHIG Core专门说明了CDASH对该字段的推荐强度,分为强烈推荐(HR)、推荐/有条件(R/C)和可选(O)三类,见图1。
强烈推荐(HR)字段,根据CDASHIG v2.3的定义,是应该始终位于CRF上的数据采集字段。推荐/有条件(R/C)字段,是建议的或有条件的数据采集字段。至于是什么条件,在Specification的实施注意事项(Implementation Notes)列中描述。而对于CRF模板来说,由于不能确定具体项目中的实际情况是否符合Implementation Notes的描述,所以模板中也应采集R/C字段。若实际项目中不需要,则由数据管理员(DM)在CRF设计时删除该字段即可。
所以,数据采集完整度将要求所有强烈推荐(HR)字段、推荐/有条件(R/C)字段都采集于CRF模板中。同时作为模板,应尽可能基于CDASHIG收录项目中常用的O类字段,特别是对数据清理有帮助的字段以及实际研究中申办方可能会感兴趣的字段。例如AE(不良事件)Domain, Ongoing Adverse Event字段,中文CRF中常译为“是否持续”。这是一个O类字段,但出于其对End Date(结束日期)和Outcome(转归)进行数据清理的价值,该字段常见于CRF设计中。又如AE Domain,Category for Adverse Event和Subcategory for Adverse Event字段也是O类字段。Implementation Notes中描述这是申办方定义的受控术语。实际研究中申办方有可能会对不良事件的类别感兴趣并进行相关统计,例如免疫相关不良反应、输液反应、剂量限制性毒性等。将这些字段及常见类别提前采集到CRF模板中就能够在实际项目中提高相关字段设计和测试的效率。
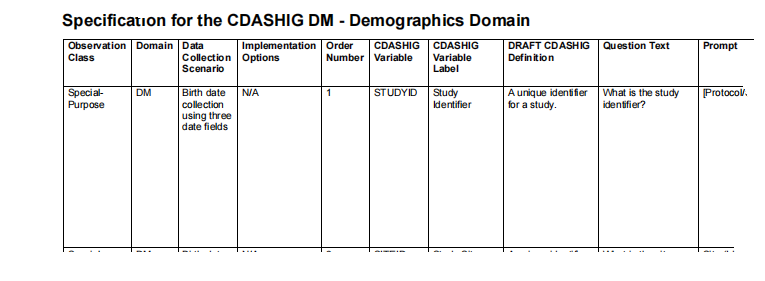

图1:CDASHIG v2.3: Specification for the CDASHIG DM-Demographics Domain(部分)
02.问题提示语使用度
CRF大都是采用提问的方式来采集试验分析所需的数据的。如何正确地提问以获取试验所需数据是CRF设计中经常需要思考的问题。CDASH的基本目的之一是减少CRFs之间不必要的可变性,即尽可能减少不同企业、不同研究数据采集间CRF的差异,因此,CDASHIG对问题文本(Question Text)和提示语(Prompt)均有指导,见图2,并提出必须逐字使用问题文本和提示语。因此,CRF模板应使用CDASHIG对应Domain中提供的问题文本或提示语来提出问题。随着近年来临床研究的本土化程度的提高,在国内开展的临床研究,其CRF多为中文语言,而CDASHIG是英语文件。这就要求CRF模板的设计者在设计提问时,应确保翻译的语句与CDASHIG保持语义一致。
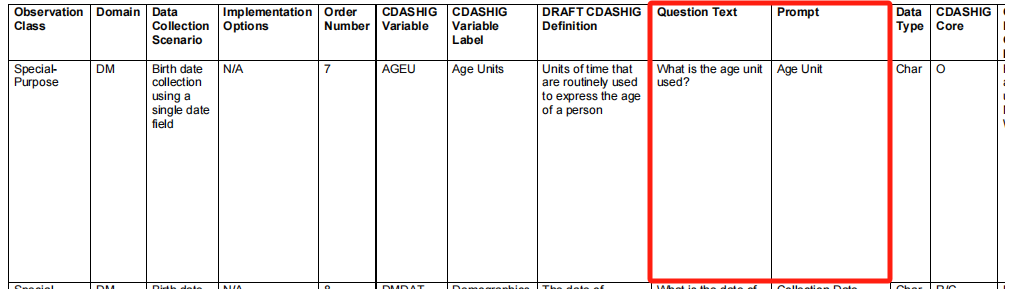
图2:CDASHIG v2.3: Specification for the CDASHIG DM-Demographics Domain(部分)
“问题提示语的使用度”指标在CDASH系列文件没有完全中文化的情况下具有一定的执行难度,因为翻译行为本身结果非唯一。因此这一点也成为了不同公司、组织之间可以拉开竞争差距的一个因素,问题的关键点就在于谁对CDASH的阅读更细致、理解更准确。例如,Tumor/Lesion Identification Domain,在中文语境中经常翻译并设计为多张表:靶病灶评估、非靶病灶评估、新病灶评估。曾有小伙伴在设计“日期”字段时,由表单名称自然地将“日期”字段命名为“评估日期”,殊不知这个设计对于统计分析来说将是灾难性的,因为CDASH对于该字段的Question Text是“What was the date of the procedure used for [tumor/lesion] identification”? 图3 Example可见其应用。并且统计分析时也不会在意是哪一天评估的,而是关注最早的能识别到肿瘤进展的日期,也就是检查的日期。基于CDASH标准的CRF模板则可以很好的规避此类由人员经验不足导致的错误。

图3:Example CRFs for the CDASHIG TU - Tumor/Lesion Identification Domain,Example 1(部分)
03.编码列表的映射度
为了数据分析的标准化和便利性考虑,对部分CRF提问的回答,CDASH有特定的备选项可供选择。CDASHIG文件中每一个Domain均有CRF元数据(Metadata)表格,其中提供了特定字段的受控术语编码列表名称(Controlled Terminology Code List Name)和允许值(Permissible Values),见图4。例如AE Domain, Action Taken with Study Treatment的允许值包括DRUG WITHDRAWN;DOSE REDUCED; DOSE INCREASED;DOSE NOT CHANGED;UNKNOWN;NOT APPLICABLE。CRF模板中所用的所有Code List均应使用或可映射至CDISC存在的控制术语,而在具体使用时可根据项目实际情况使用控制术语的子集,例如:如果方案规定不可增加剂量,则实际使用中可删除DOSE INCREASED并使用其余的子集,但不能在编码列表中增加选项,因为AE Action Taken with Study Treatment是不可拓展的(non-extensible)。编码列表的映射度能够反映以CDISC已发布的控制术语为标准的CRF问题应答的标准化程度。
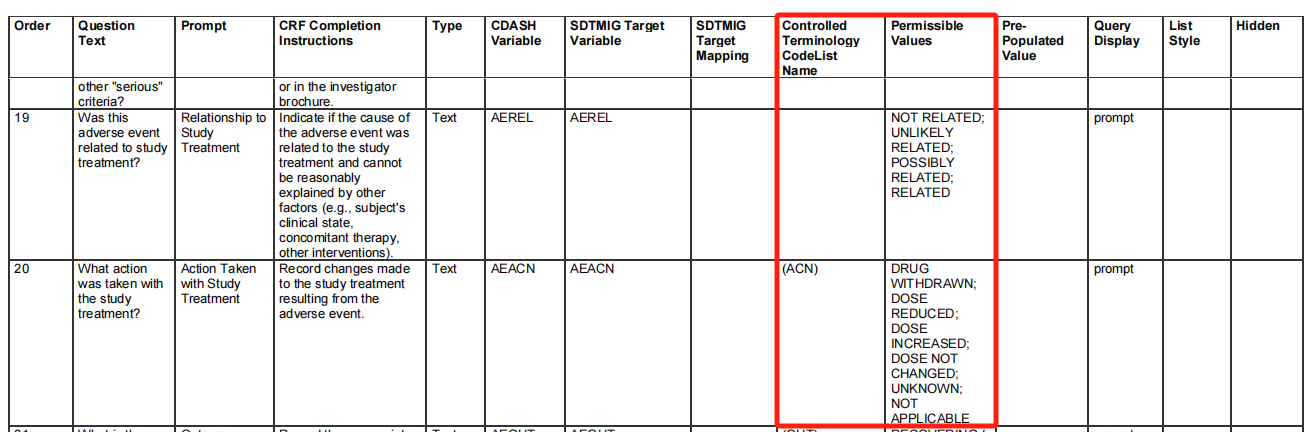
图4:CDASHIG v2.3: CRF Metadata for the CDASHIG Adverse Event Domain(部分)
04.变量命名的规范度
CDASH要求在数据库中应使用其规定的变量命名规范。通过对根变量名和/或受控术语使用一致的语法,可将采集的值有效映射到SDTM数据集所需的任何其他标准化概念。从而自EDC到SDTM数据集的变量名从头到尾均可追溯,并可支持自动化EDC设置和其他下游过程。以AE Domain为例,部分字段和CDASH、SDTM对应关系如表1所示。如果需要建立的某个字段是CDASHIG中未作规定的,则按照CDASH建议的命名标准<Topic Variable values > _<Qualifier(s)>_<SDTMIG Target>命名。由于SAS数据集转SAS传输格式(SAS transportformat,XPT)文件时变量名不能超过8位,通常在CRF设计时变量名尽量不超过8位。可见在CRF模板制订时就使用CDASH规定的变量名或命名方式,将会有效避免不同的数据库编程员由于各自对字段和标准的不同的理解而造成的变量名不统一、不规范进而降低生成SDTM时的效率。
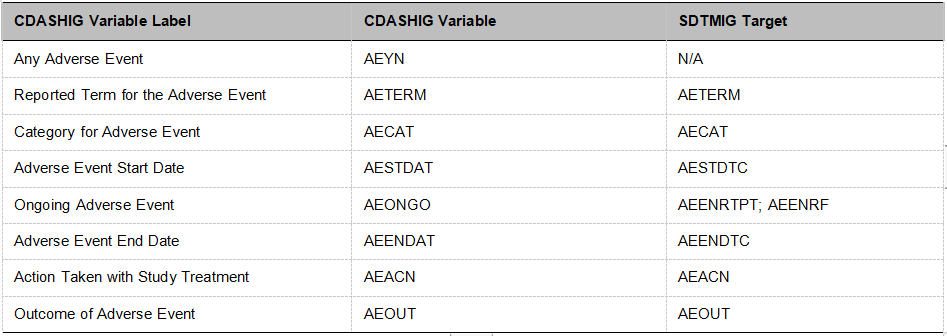
表1:AE Domain部分字段CDASH、SDTM变量对应关系
以上四项指标可勾勒出CDASH对独特表单(unique page)设计的要求,故将其视为评价CRF模板的核心指标。
05.CRF模板的丰富度
然而CRF模板因其适用范围的广泛性要求,不仅对unique page设计有特定要求,从整体来看,对CRF模板所体现的丰富度也有特殊的需求。丰富度涵盖范围很广,至少包括:①Domain的丰富度:CRF模板在多大程度上覆盖了CDASHIG所描述的Domain?对于CDASHIG所没有描述的而实际项目中经常使用的,是否基于CDASH标准进行了模板制作?②语言类型的丰富度:是否有多语种的CRF模板可供选择?③适用EDC系统的丰富度:考虑到不同EDC系统各有特性,是否有适用于不同EDC的CRF模板可供使用?④适应症的丰富度:CDISC已开发几十个治疗领域(Therapeutic Areas | CDISC)的用户指南(Therapeutic Area User Guide,TAGU),指导不同治疗领域相应数据如何采集,是否有适用于不同适应症的CRF模板可供使用?⑤场景的丰富度:CDASHIG文件本身有数个Domain针对不同的使用场景给出了不同的示例。例如ECG检查分为了中央读取、本地读取、中央处理三种情形。再者,以EX Domain为例,实际工作中,CRF模板最好能涵盖多种不同的给药方式。这些对于使用场景的丰富度的需求可根据实际情况在CRF模板中予以体现。
由此,CRF模板的评价可描述为核心指标+丰富度的立体指标。高度依从于CDASH标准是CRF质量的保证,而高质量的CRF模板因其可重复使用性,若配合良好的公司内部流程,则可大大提高CRF设计的效率。更重要的是CDASHIG和SDTMIG相互对齐,由此在数据的分析和递交阶段的效率也可大大提高,从而使个别劳动时间低于社会必要劳动时间并由此获得收益。
06.企业标准CRF模板的高效利用和持续优化
基于CDASH标准的CRF模板一旦建立,其对于实际工作的意义不容低估。但若要使模板获得高效的利用还需要其他配套措施:
其一,标准流程的支持和规定。在流程的层面上将使用CRF模板作为CRF设计的首选流程,从而确保标准文件的使用在团队内部形成指定路径。
其二,人员的培训。CDASH及其相关文件数量较多,最新版本包括CDASH v1.1,CDASHIG v2.3,CDASH Model v1.3,CDASH SAE Supplement v2.0。CRF模板应是一个已经将CDASH标准经过转化后形成的工具。在工具使用过程中并非每一位使用者都清楚模板制订的内在逻辑。这就需要在实际使用时有培训、有指导。
其三,持续的优化。CRF模板并不是一个静态的文件,在实际使用过程中常常会发现其内在的不足。长期基于缺陷较严重的模板工作将会使工作效率和质量降低。因此模板在使用过程中需有反馈和修改机制相配套。
其四,突破部门的界限,达成对模板使用和改进的共识。数据采集是一项跨部门的工作。在实际工作中,数据管理部门经常收到来自医学、运营、统计等部门对于CRF的需求。往往有部分需求对于CSR(Clinial Study Report,临床研究报告)的撰写来说并非必须。理论上基于CDASH的CRF模板已将CDASH标准中规定的需要采集的数据涵盖进来,在具体项目中针对方案补充CSR撰写所需的数据即可,最后CSR不分析的数据不一定要出现在CRF中。在实际工作中若能达成此共识,则可大大减少项目启动阶段的沟通成本,促进效率的提高。若实际工作中某些字段的设置的确可以大大提高数据审核的效率,则可考虑将其增加到模板中从而提高所有使用者的工作效率。
企业标准CRF模板的建立本身是一件长期且耗费时间耗费精力的工作。但从长远角度来看,则可大大减少实际工作人员的重复劳动,使人员可将宝贵的精力更多地使用在数据的清理上,从而确保高质量的数据采集。
参考文献:
[1] Clinical Data Acquisition Standards Harmonization (CDASH) Version 1.1.[2011-01-18].https://www.cdisc.org/standards/foundational/cdash/cdash-v1-1
[2] Clinical Data Acquisition Standards Harmonization Implementation Guide for Human Clinical Trials Version 2.3(Final).[2023-09-28].https://www.cdisc.org/standards/foundational/cdash/cdashig-v2-3
[3] SCDM.Good Clinical Data Management Practices.[2013-10]
[4] 高菡.基于CDASH标准对临床试验病例报告表设计的评价[D].复旦大学.2014
[5] 陈建芳,娄冬华.基于CDASH标准的肿瘤临床试验病例报告表设计[J].中国临床药理学与治疗学,2022 Jul;27(7):762-767
徐冠群 撰写