



 有临
有临
 2024.10.24
2024.10.24
 2718
2718

抗体-药物偶联物 (antibody-drug conjugate,ADC)由人源化/人单克隆抗体、细胞毒性有效载荷和可切割/不可切割的连接子组成。ADC药物的一般作用机制:ADC药物进入体内后,靶标特异性的单克隆抗体与其靶细胞表明抗原受体特异性结合,ADC药物被肿瘤细胞内吞后,进入溶酶体进行降解,小分子细胞毒性药物在胞内以高效活性形式被足量释放,释放的有效载荷与其靶标结合,从而完成对目标肿瘤细胞的杀伤(图1)【1】。ADC药物自20世纪90年代中期首次进入临床试验以来,目前ADC药物已成为肿瘤学领域的研发热点。
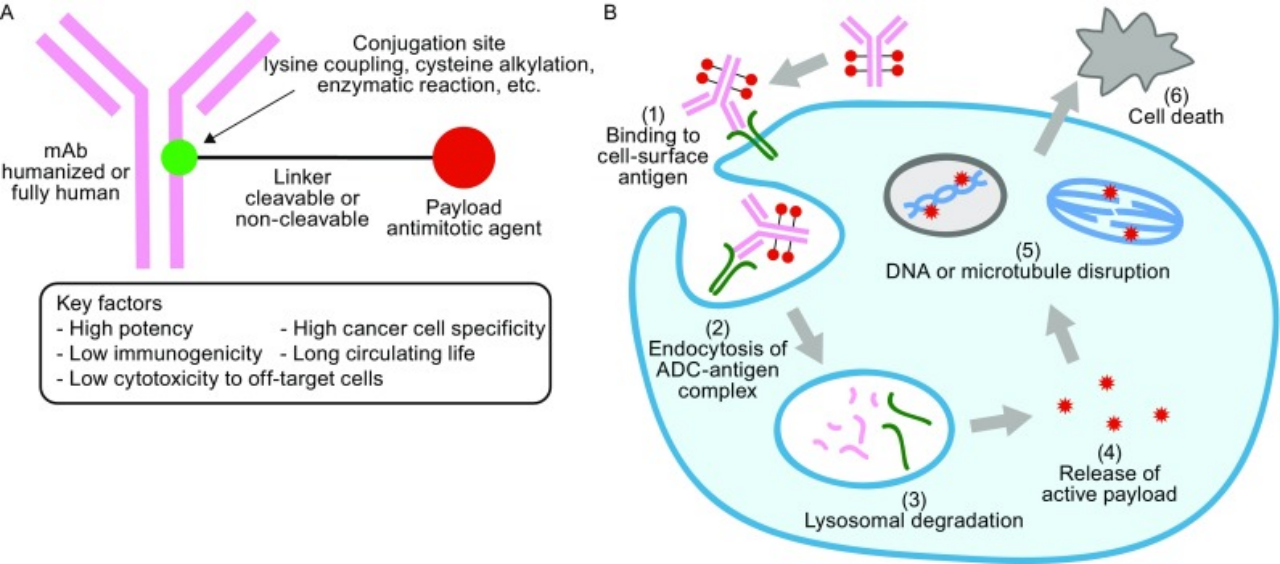
图1.ADC药物的结构和作用机制
从靶点抗体的选择到最终的产品,ADC的开发是一个极具挑战的过程。临床药理学作为药物开发的重要工具,对于深入理解ADC药物及指导药物的开发具有重要作用。ADC的临床药理学需要综合小分子和抗体(大分子)开发策略的要素,包含接头/细胞毒性药物技术、ADC的异质性、药代动力学(PK)和临床开发中特定ADC的安全性/有效性。与其他小分子或大分子不同,ADC药物的PK相对复杂,ADC的药动学研究面临更多挑战,主要体现在ADC药物的ADME(吸收、分布、代谢、排泄)过程。由于ADC药物的组成既包含小分子毒素也包含大分子抗体,因此ADC药物在临床上多通过静脉给药。因此ADC药物的ADME过程只考虑分布、代谢和排泄过程。
ADC药物的分布
ADC采用注射方式给药,保证药物可以快速到达全身各部位。传统小分子在组织中分布广泛,抗体主要分布在血液和细胞外液,尤其在靶器官内表达量高【2】。ADC 药物的空间结构主要由抗体构成,因此体内分布与抗体虽更为类似,但具有自身特殊性。ADC药物进入血液后,初期主要分布在血管,之后扩展到组织间隙。ADC药物难以穿过血管上皮细胞,组织分布较低。研究显示T-[3H]DM1 和[3H]SGN-75在所有组织中的放射性信号都比血液低, 证实ADC的组织分布程度低。ADC药物在血流量大的组织,如肝、肾、肺和心脏中分布程度较高,而T-[3H]DM1和[3H]SGN-75则更高, 同时也间接证明ADC在血液中的分布程度非常高。ADC的分布会受目标抗原分布的影响,肿瘤组织与靶组织的药物摄取量较其他组织相比更高。与裸抗体不同的是, 抗体与效应分子的结合可能会影响到ADC药物的分布。Boswell等通过动物实验表明,当 MMAE效应分子与STEAP1抗体偶联后形成ADC,其结合型抗体和游离效应分子在大鼠肝脏的分布均显著增加,且在正常组织和肿瘤组织的分布减少。有研究者在抗体和小分子毒素上进行双重放射性同位素标记研究,结果显示,小分子毒素MMAE与抗体在多数组织中分布相似,但在肝中小分子毒素的浓度高于抗体,肝脏的代谢释放更多效应分子的结果所致。
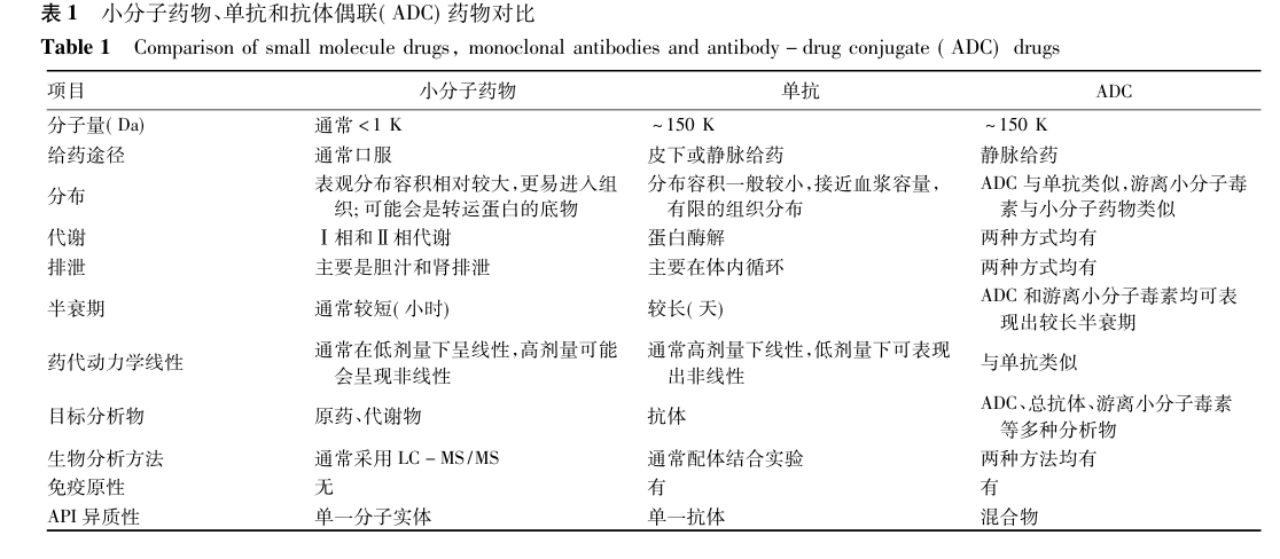
图2.小分子、单抗和ADC药物对比
ADC药物的代谢
ADC的药物代谢有2种形式:一是连接子(偶联子)通过受体介导的化学/酶裂解,释放出游离的小分子效应分子;二是ADC药物中的抗体部分水解成多台和氨基酸,还包含一些效应分子的结构类似物(带有氨基酸/偶联子的效应分子),这些代谢产物具有较高的细胞毒性。ADC药物产生的自由效应分子和效应分子类似物会在体内进行进一步的代谢和生物转换(如通过CYP450酶代谢)【4】,理论上可能在与其他小分子药物进行联合治疗时存在DDI风险,进而会影响ADC药物的代谢及联合药物的血药浓度,但由于ADC药物在体内循环系统中释放出的小分子毒素浓度较低,通常产生DDI的风险较低。
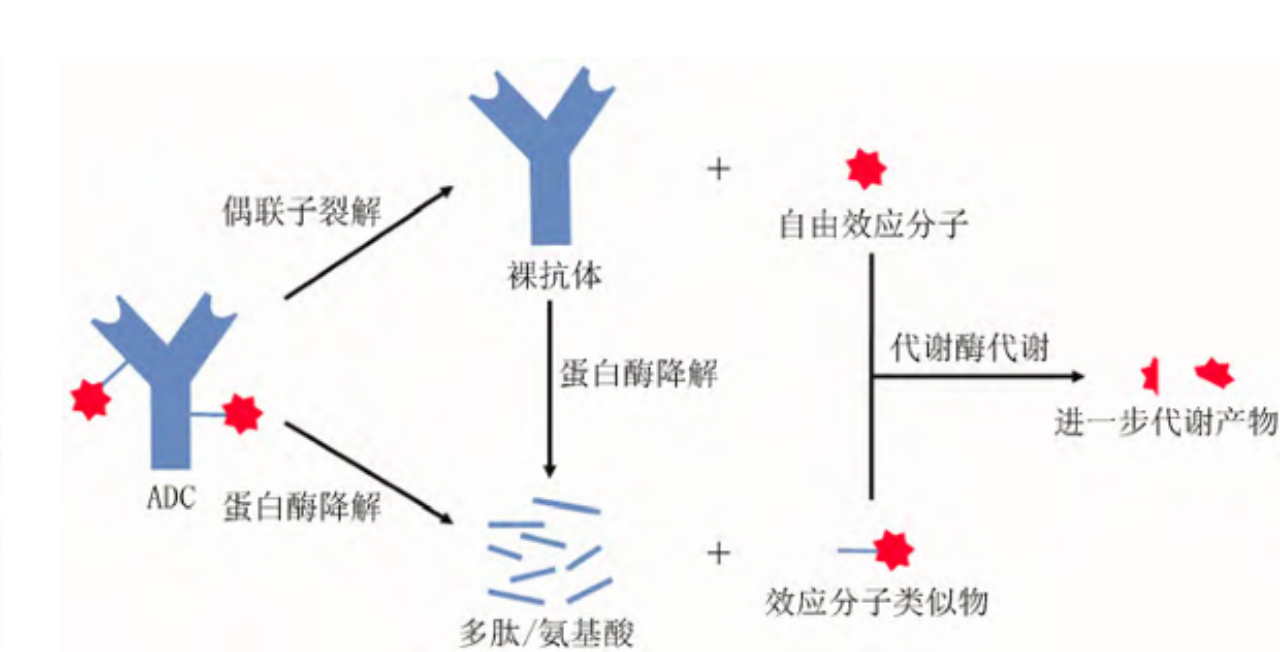
图3.ADC代谢方式示意图
ADC药物的排泄
完整的ADC药物及裸抗体分子比较大,不通过肾小球过滤排泄,而是以氨基酸形式被再次吸收。但抗体的降解产物、游离的效应分子,及带有氨基酸/偶联子的效应分子等分子量较小的物质,则可以通过肾小球排泄。另外, 部分代谢产物也有可能通过转运体的介导而被排泄至粪便中。
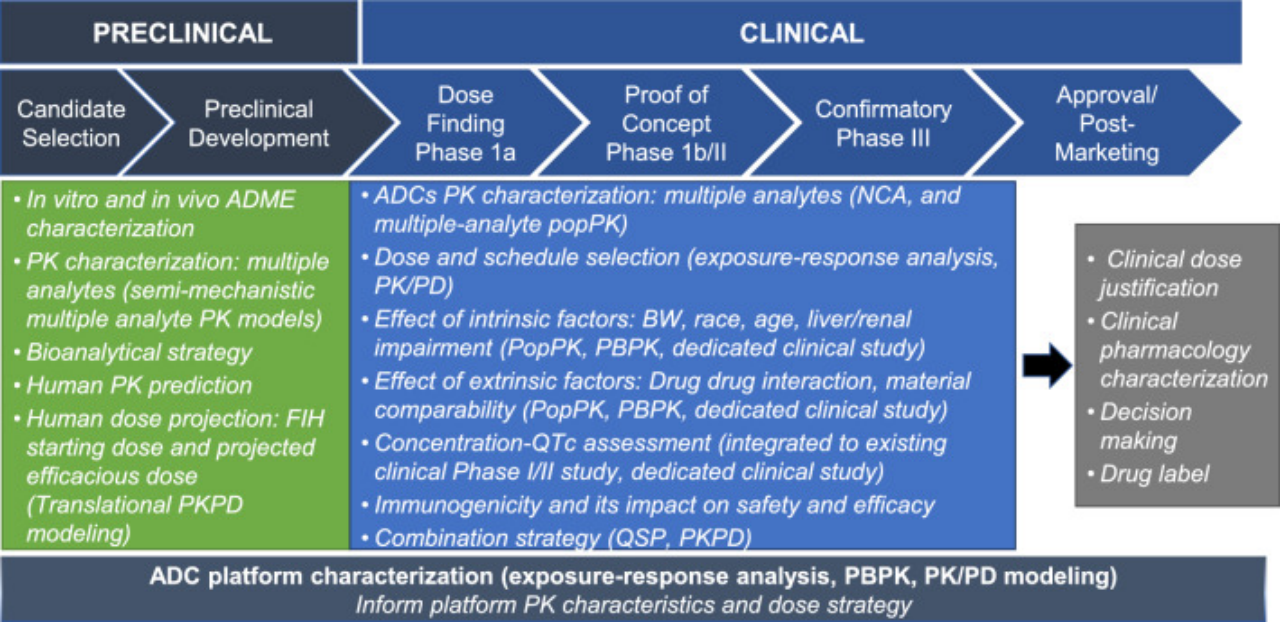
图4.ADC药物的临床药理学评估
ADC的临床药理学研究要根据ADC自身特有的PK特征加以分析。图4总结了ADC的临床药理学评估,以解决科学和监管问题【3】。在 I 期、II 期和 III 期临床研究中需要测量多种分析物,包括但不限于ADC偶联物(以偶联抗体或偶联有效载荷)、总抗体(TAb、偶联和非偶联抗体)、未偶联抗体和非偶联(游离)有效载荷,以表征ADC的PK。可使用popPK、PBPK等方式探讨内在因素(例如体重、器官功能障碍)和外在因素(例如,伴随药物)对ADC药物的PK特征的影响。应用模型的方法可以探索ADC偶联物(和其他相关分析物)暴露与疗效/安全性之间的关系,以支持临床给药方案的选择。以下重点对ADC给药策略和剂量-暴露关系分析相关的内容进行梳理,以便总结与 ADC 药物临床剂量优化相关的思路,主要包括【4】:
1.临床开发中的剂量选择
FDA 强烈建议在早期药物开发中探索 ADC的广泛剂量范围,包括多个剂量水平和/或给药方案(例如,单次或多次给药),以充分表征ADC及其活性成分与安全性和活性之间的关系。在适当的时候,还应考虑评估固定剂量和基于体重的剂量。通过使用早期临床研究的数据进行暴露反应分析,可以了解后期开发中使用的给药策略或策略的选择。
2.针对内在和外在因素的剂量策略考虑
ADC的不同组成部分可以独立影响安全性和/或有效性,因此基于内在和外在因素确定推荐剂量具有挑战性。例如,调整特定患者亚群的ADC剂量以实现一个组成部分(例如,通常是有效载荷)与在总人群中观察到的剂量的相似暴露,可能会导致ADC暴露发生变化,随后,疗效发生变化。因此,在ADC开发计划中,应评估内在和外在因素对PK、安全性和有效性的影响,以便为标签设计提供信息,其中应包括用于特定患者亚群的风险缓解策略。
3.生物分析考量
所有生物分析方法均应按照 FDA指南中题为M10生物分析方法验证(2022年11月)的规定进行验证和报告。一般来说,从首次人体研究开始,应使用经过验证的分析来测量ADC及其组成部分。在开发后期,应测量ADC、组成部分及其在体循环中可量化的药理活性代谢物,用于暴露-效应分析。如果未检测到脱偶联的有效载荷,可能不需要进行检测;如果ADC仅作为载体,且总抗体浓度与ADC高度相关,可能无需检测总抗体。
4.免疫原性
ADC的任何部分都可以产生对ADC的免疫应答,包括抗体、偶联有效载荷或偶联接头产生的表位。鉴于 ADC 的治疗范围通常相对较窄,因此评估对ADC的免疫原性以及对 PK、安全性和有效性的潜在影响非常重要。总的来说,ADC药物的ADA发生率在靶向血液肿瘤的患者比靶向实体肿瘤的患者少;大多数ADA是针对ADC的单克隆抗体结构域的。此外,在大多数患者中,这些ADC的半抗原样结构并不比治疗性单克隆抗体产生更多的免疫应答风险。
5.特定研究的考虑
在器官功能障碍人群的临床试验中,建议检测 ADC、脱偶联的有效载荷和药理活性代谢物的水平。一般来说,ADC的抗体部分发生直接离子通道相互作用的可能性较低,不需要进行QT评估,除非机制考虑或来自临床或非临床研究的数据表明存在致心律失常风险。QTc 评估应侧重于未偶联的有效载荷、接头和任何药理学相关代谢物,QT间期延长风险的表征应与小分子药物类似。QT评估计划中的所有提案都应有充分的论据,并与FDA讨论。在DDI(药物-药物相互作用)研究中,如果脱偶联有效载荷可检测,仅检测有效载荷可能是足够的;如果抗体也可能参与DDI,可能还需要检测ADC或总抗体。
ADC药物的临床药理学研究在现代肿瘤治疗中具有重要意义和价值。它不仅通过优化靶向治疗,提高疗效并降低副作用,还为剂量选择、个体化治疗和安全性评估提供了科学依据。这些研究有助于揭示耐药机制,支持临床试验设计,并增强监管机构的信心,从而推动ADC的开发与应用。
参考文献:
【1】Tsuchikama K, An Z. Antibody-drug conjugates: recent advances in conjugation and linker chemistries. Protein Cell. 2018 Jan;9(1):33-46. doi: 10.1007/s13238-016-0323-0. Epub 2016 Oct 14. PMID: 27743348; PMCID: PMC5777969.
【2】郭建军,高然,权腾飞,等.抗体偶联药物的药代动力学研究进展[J].药学学报, 2015, 50(10):7.DOI:CNKI:SUN:YXXB.0.2015-10-007.
【3】Liu SN, Li C. Clinical pharmacology strategies in supporting drug development and approval of antibody-drug conjugates in oncology. Cancer Chemother Pharmacol. 2021 Jun;87(6):743-765. doi: 10.1007/s00280-021-04250-0. Epub 2021 Apr 1. PMID: 33792763; PMCID: PMC8110483.
【4】Clinical Pharmacology Considerations for Antibody-Drug Conjugates, Retrieved February 11, 2022, from https://www.fda.gov/media/155997/download.
谢珊珊 撰写 韩海雄 审核