




 2021.11.05
2021.11.05
 5922
5922

ADA对药物安全和疗效方面的影响[1]
大分子药物作为外源物质进入人体或动物体内具有诱导机体免疫应答的能力,通过自身免疫系统会产生针对药物的抗药抗体(ADA)甚至中和抗体(NAb)。前者会引起患者强烈的免疫反应,甚至危害病人生命安全,后者能够抑制生物药的生物活性而减弱其药效。免疫原性不仅能影响药物的安全性和有效性,还可能产生严重的副作用甚至危及生命。因此,免疫原性评价,是生物药临床前及临床中不可或缺的部分,也是上市后患者需要监测的重要指标。
近年来,随着临床试验中药物因免疫原性的产生而终止研究或撤市的发生,业界对免疫原性评价的评估策略、检测方法、数据使用等方面达成了越来越多的共识。监管机构对生物药的免疫原性研究的深度、程度、数据质量也提出了更高的要求,本文对免疫原性的概念、形成机制、引起因素、生命周期、研究策略以及检测方法和参考的法规指导原则作了详细的介绍。
01 免疫原性
免疫原性指的是抗原激发免疫反应的能力,也指抗原刺激机体后,机体免疫系统形成抗体或致敏T淋巴细胞的特异性免疫反应的能力。在生物治疗过程中,对治疗性抗原(重组蛋白,单抗)的免疫反应是非常不利的,会产生细胞因子释放综合症 (CRS),或者是抗药性抗体产生 (ADAs),削弱治疗效果,对治疗产生反作用。严重时,会导致过敏、器官衰竭等。药物引起的免疫反应是药物安全性和有效性的重要指标之一。
具有免疫原性的物质,通常来说,分子量越大,免疫原性越强,分子量低于4000,一般不具有免疫原性,分子量在4000和10000之间,呈弱免疫原性,分子量高于10000者,具有较强的免疫原性。但是有例外,比如明胶,分子量可达10万,但呈弱免疫原性,因为它是容易降解的直链氨基酸结构。
02 免疫原性的形成机制
治疗性蛋白引起的机体免疫反应主要是由适应性免疫(细胞免疫和体液免疫)和固有免疫两部分构成,固有免疫主要是由微生物污染等所致,临床上讨论更多的是对于治疗性蛋白的适应性免疫反应的讨论与监测。适应性免疫既包括细胞免疫介导的细胞因子释放作用,又包含体液免疫介导的抗药抗体的产生。
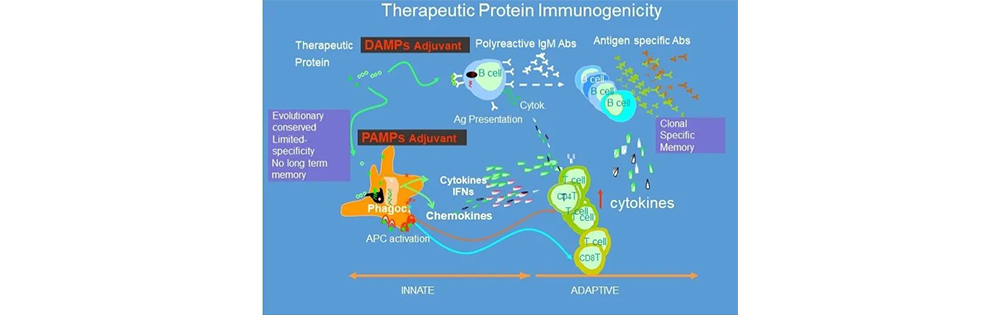
图1 FDA关于治疗性蛋白 免疫原性产生机制的示意图[2]
细胞免疫一般过程包括T细胞的分化以及细胞因子的释放,可以引起不同T细胞亚型的比例的变化和外周细胞因子水平的变化。
体液免疫主要通过B细胞产生的针对治疗性蛋白的抗药抗体(anti-drug antibodies, ADAs)来发挥作用。抗药抗体不仅包括结合药物的抗体(binding antibodies,BAbs),也可以是阻断其功能的中和抗体(neutralizing ADAs,NAb)。根据产生机制通常可分为T细胞依赖途径和非T细胞依赖两种机制。
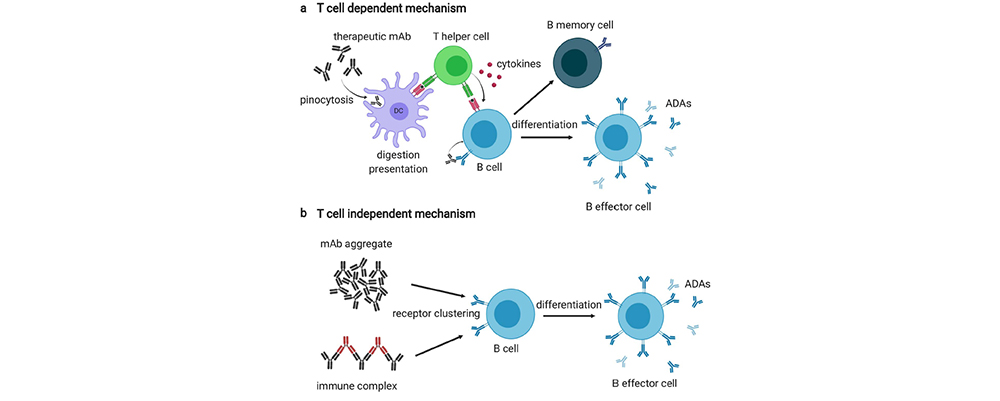
图2 抗药抗体的产生机制
03 引起免疫原性的因素
抗药抗体(Anti-drug antibody,ADA)是抗体药物免疫原性评价的主要方式。ADA的形成可以分为与患者相关的因素和与药物相关的因素。

患者相关因素包括:
1) 遗传因素:不同人种,遗传背景的差异,导致其对同一种药物的ADA产生也可能是不同的。病人ADA出现和病人当时的免疫状态,主要组织相容性和人类白细胞抗原等位基因的差异相关。
2) 患者疾病状态:有无过往的微生物和病毒感染史;疾病相关因素影响免疫原性;先前接触过类似或相关的单克隆抗体也会影响免疫原性等。
3) 给药方案:重复给药或间歇给药比一次性使用的单克隆抗体诱导免疫原性的可能性更高;如联合使用免疫抑制剂,ADA会降低。
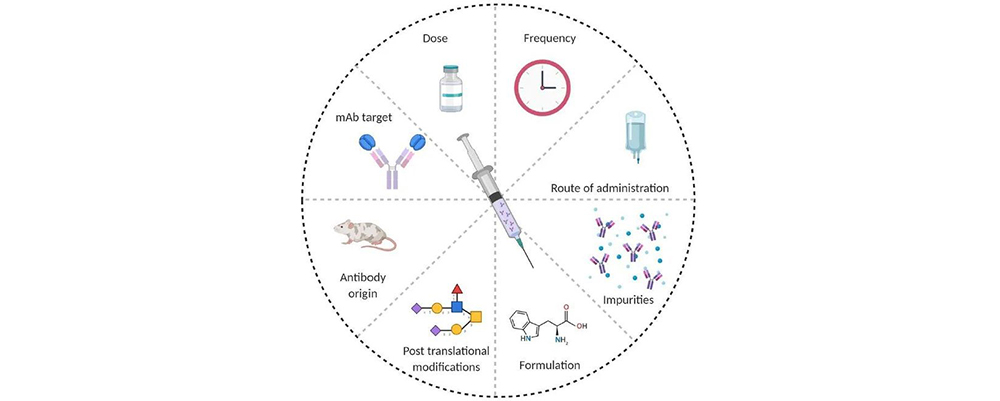
与药物相关的因素:
1) 抗体源性:尽管为了降低免疫原性,先后开发了嵌合抗体,人源化抗体和全人源单抗,但是人源化改造,并没有完全消除ADA,即使人源化抗体的CDR区,依然有强的免疫原性,产生抗独特型抗体。
2) 配方、容器系统、储存条件会影响产品的免疫原性。这些因素可能通过成分与治疗蛋白质和容器封闭系统的相互作用影响免疫原性,例如蛋白质构象的改变、作为免疫佐剂的杂质的提取、引起诸如聚集、微粒或脱酰胺等改变。
3) 改变的糖基化模式可降低或增强分子的免疫原性,例如通过屏蔽蛋白质主干或通过Toll样受体触发先天免疫应答。
4) 非典型的糖基化模式,例如可能发生在全新的表达系统中,与通常使用的表达系统相比,可能引起免疫原性的改变。
5) 其他有助于免疫原性的因素包括产生方法、途径、剂量和给药频率产生的杂质。
04 免疫原性的生命周期
免疫原性除了对受试者急性或长期的安全性影响,还可影响药物的药代动力学(PK)、药效学(PD)、生物利用度和疗效性。正是基于此,FDA在2019年发布的免疫原性评估指导原则《Immunogenicity Testing of Therapeutic Protein Products —Developing and Validating Assays for Anti-Drug Antibody Detection Guidance for Industry 》中则直接将“免疫原性”定义为治疗性蛋白产品对自身和相关蛋白产生免疫应答或诱发免疫相关临床不良事件的倾向[3]。免疫原性影响贯穿药物研发的整个生命周期,从物质筛选直至上市批准后都应该对免疫原性以及带来的临床影响进行监测。

05 免疫原性的研究策略和流程
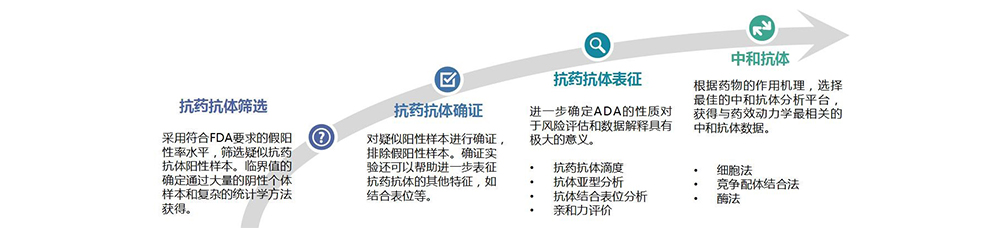
对于ADA的检测,NMPA、FDA、EMA均提倡分级评估的策略,首先对所有样品进行筛选试验,其次对阳性样品的特异性进行确证试验,对已确定的阳性样品进行滴度试验,以及通过功能性试验对抗体中和活性进行检测。其中在已确定的阳性样品中,还应考虑确定抗体同种型、亚型和结合表位的检测。NMPA、FDA、EMA对免疫原性多层级检测决策树基本一致,如下图所示:
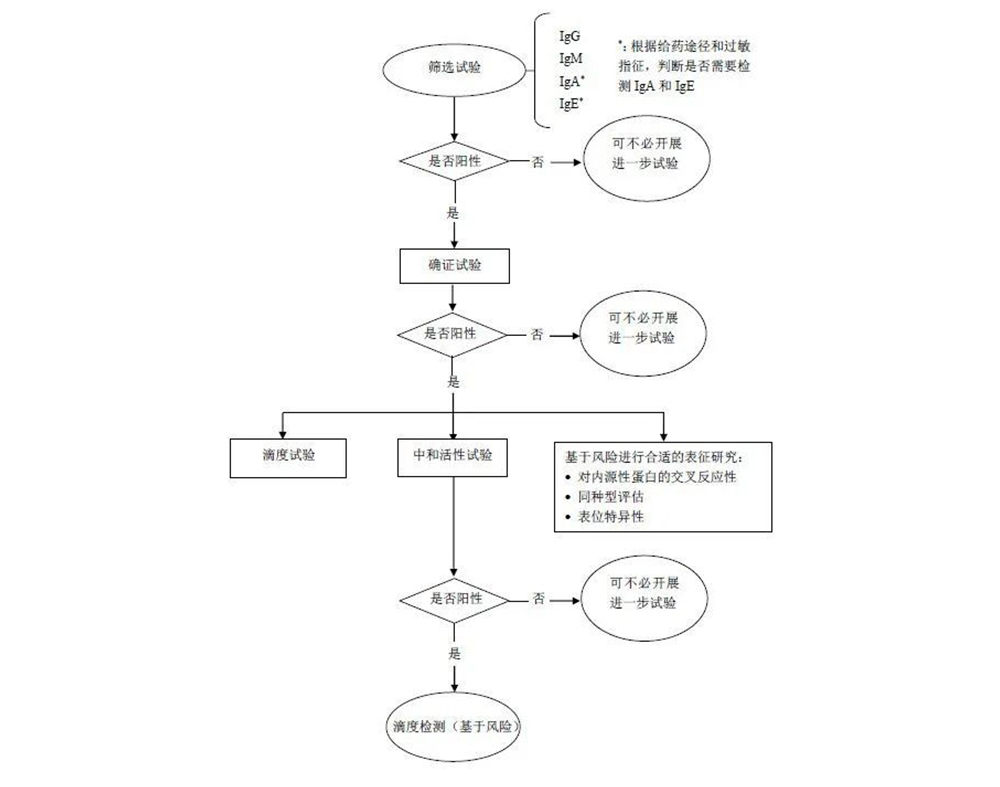
图6 免疫原性评价策略[4]
基本流程:
06 免疫原性的检测方法
免疫原性研究主要聚焦在抗药抗体的检测和表征上,应获得抗药抗体的发生率、滴度、存续时间和中和能力数据。
抗药抗体的检测可以使用多种生物分析平台来完成,包括ELISA( Enzyme-linked immunosorbent assay)、ECL(Electrochemiluminescence)、RIA(Radioimmunoassay)、 SPR(Surface plasmon resonance)。
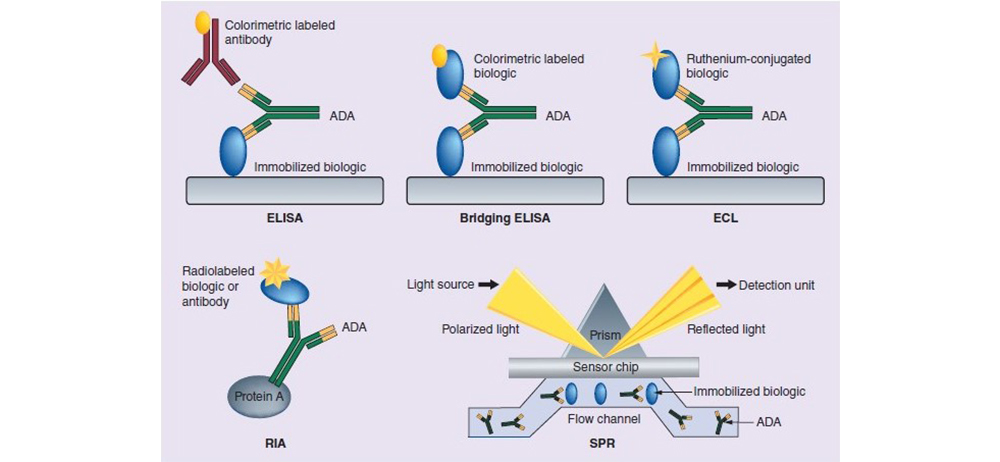
图7 各种抗药抗体检测平台的原理
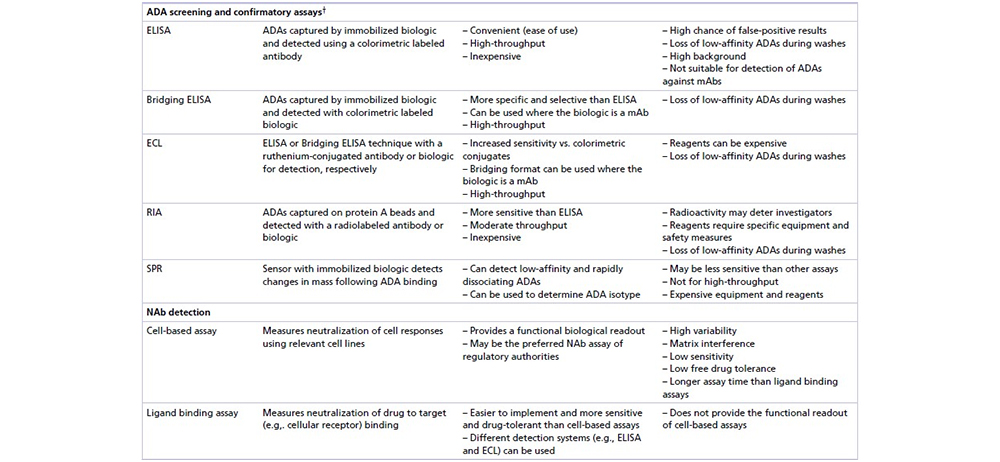
表1 免疫原性各种检测平台的优缺点[5]
目前市场上抗药抗体检测平台使用最为频繁是ECL(电化学发光)和ELISA(酶联免疫)平台,ECL技术以较高的灵敏度占领抗药抗体检测的绝大多数市场,越来越受到各个药企的青睐。中和抗体检测一般基于药物的作用机制进行设计,USP1106对常见的药物作用机制进行了分类,并给出了推荐的方法选择,为了更全面的反应药物的作用机制,一般中和抗体检测选择基于细胞的分析方法平台。
07 免疫原性的法规指导原则

目前,世界范围内多数地区或组织并无免疫原性综合评价的指导原则,对免疫原性评价的要求、标准、解释比较混乱,评价的主要标准目前还依赖FDA、EMA等机构的指导原则。2021年3月29日国家药品监督管理局正式发布实施《药物免疫原性研究技术指导原则》,填补了我国免疫原性研究相关技术规范的空白。随着国内药物研发技术的发展以及药物研发人员水平的提高,中国必将在免疫原性评估领域方面作出更多贡献。
参考文献
1、2019 ASCPT Annual Meeting artwork designed by GRAPHEK Design Studio. ADA.
2、João A. Pedras-Vasconcelos, PhD The immunogenicity of therapeutic proteins-what you don’t know can hurt you and the patient. SBIA REdI Fall 2014.
3、Immunogenicity Testing of Therapeutic Protein Products — Developing andValidating Assays for Anti-Drug Antibody Detection Guidance forIndustry,January 2019.
4、 《药物免疫原性研究技术指导原则》,NMPA, 2021.03.
5、USP,1106.1,Immunogenicityassays—design and validation of Assays to detect anti-drug neutralizing antibody , May 1, 2016.
图片来源于网络