



 有临
有临
 2023.05.04
2023.05.04
 3759
3759

4月19日晚,有临医药携手CMAC成功举办“肿瘤早期临床试验的创新设计”直播,有幸邀请到领承创投合伙人张子豹先生担任主持以及三位业界大咖参与:中国药科大学理学院生物统计系主任,生物统计与计算药学研究中心主任言方荣教授、有临医药首席医学官韩海雄博士、有临医药生物统计高级总监张磊先生,从不同视角展开探讨。

TOPIC 1 肿瘤早期临床试验设计研究进展

言方荣教授
中国药科大学理学院生物统计系主任,生物统计与计算药学研究中心主任
过去十年,肿瘤早期临床试验研究领域飞速发展,为满足临床开发需求,各国监管理念也在产生不断变化,特别是中国新药审评中心出台了一系列促进早期临床试验开发的指导原则。其中对适应性设计和主方案设计的使用、基于生物标记物驱动实验的设计方法、扩展倍的研究等一系列创新性的实验设计方法,大多集中在早期的临床试验。
言教授通过Ⅰ期、Ⅱ期及主方案设计三个方面总结了过去十年肿瘤早期临床试验设计的研究进展。
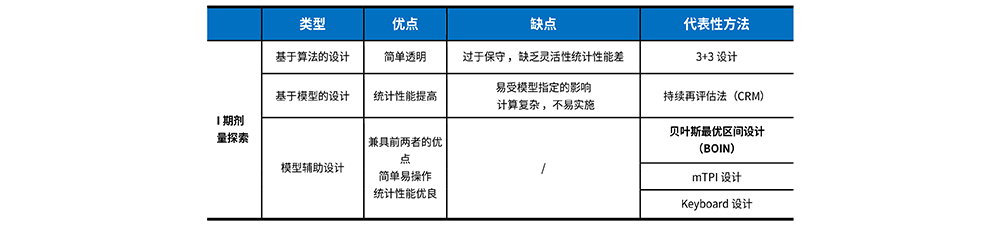
Ⅰ期临床试验设计
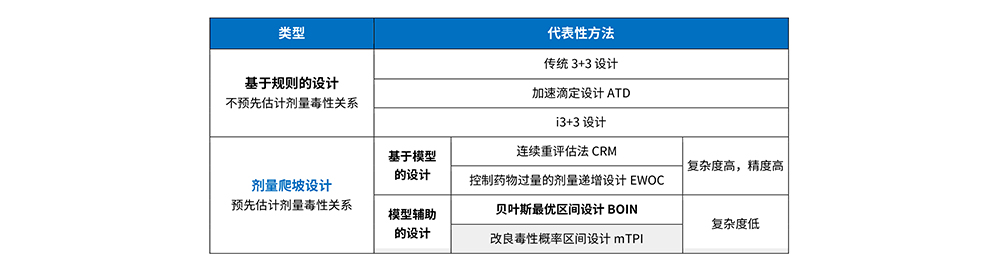
过去在Ⅰ期剂量爬坡的探索阶段,通常会使用传统的算法设计(3+3设计)、模型设计(CRM)。但两者各有利弊,直到兼具简单易操作且统计性能优良特点的模型辅助设计出现,其中较有代表性的包括:贝叶斯最优区间设计 (BOIN)、mTPI、Keyboard 设计。
主要目的:探索 MTD、DLT、给药方式,并确定 II 期推荐剂量
BOIN设计
已获得中国CDE认可与美国FDA的Fit-for-Purpose认证
统计精准且操作性能显著优于传统3+3设计,剂量增减的决策只需依据当前剂量下的观测DLT率与预设的最优化剂量增减边界的比较。
越来越多的临床试验采用BOIN设计。截止2021年7月19日,据clinicaltrials.gov统计,已有400多例 I 期临床试验使用BOIN设计进行剂量探索。2020年9月获得FDA加速批准,用于治疗RET基因融合突变的转移性NSCLC患者的RET抑制剂普拉替尼,其I/II期临床研究(NCT03037385)的剂量探索阶段使用的就是BOIN设计。
BOIN设计现已发展出多个变种方法以应对不同的临床问题:
-针对毒性延迟效应的TITE-BOIN;
-可纳入先验信息iBOIN;
-考虑药物联合治疗的BOIN Comb;
-同时考虑毒性和有效性的U-BOIN、BOIN12等。
Ⅰ-Ⅱ期临床试验设计
新型的分子靶向药物和免疫治疗药物(如PD-1/PDL-1、CAR-T、ADC药物等)的有效性和毒性可能随剂量先增加后平稳,甚至降低,即不满足量效和量毒的单调关系,导致“先 I 期后 II 期”的传统试验设计框架不再适用,促使同时评估新药毒性和有效性的 I-II 期试验设计框架提出。
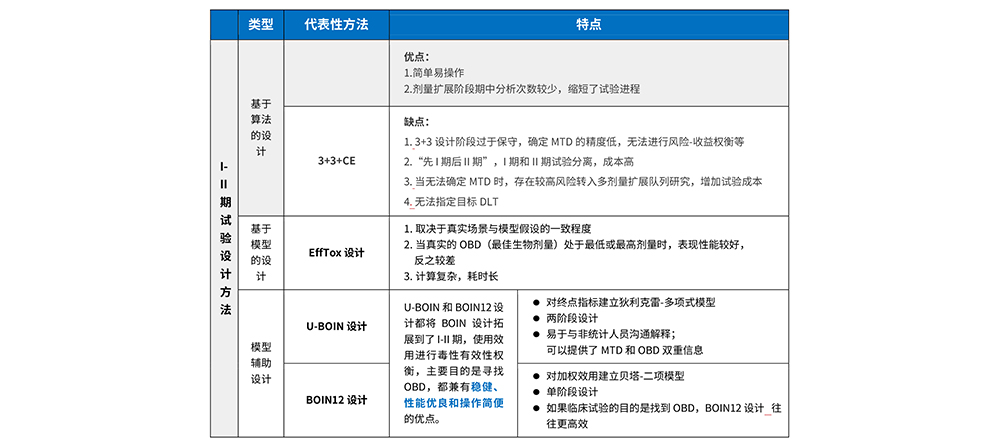
10,000个随机场景的模拟结果:
-U-BOIN和BOIN12的平均表现性能相似
-U-BOIN可以提供了MTD和OBD双重信息;而BOIN12设计探索OBD更高效
-EffTox的正确选择概率和安全性控制都略差于模型辅助设计
*3+3+CE设计是一个“先 I 期后 II 期”的传统试验设计,首先用3+3设计确定MTD,然后在MTD处采用Simon二阶段设计进行队列扩展
主方案设计
在单一方案下同事检测多种试验药物和/或多个肿瘤适应症,且无需为每次试验指定新方案的试验设计。包含篮式设计(异病同治)、伞式设计(同病异治)和平台设计(篮式设计和伞式设计的综合体,类似新药筛选)。主要关注点在于队列间的异质性、信息的借用以及I类错误的控制。
TOPIC 2 临床试验设计中BOIN的基本原理与实践操作

张磊
有临医药生物统计高级总监
2021年12月10日,袁鹰教授的BOIN设计获得美国FDA的Fit-for-Purpose认证。这是首位由华人教授发明的获得FDA官方认证的创新I期临床设计,也是继2020年12月31日纳入CDE《抗肿瘤药物临床试验统计学设计指导原则(试行)》中后,BOIN设计在全球重要药品监管机构取得的又一重要认证。
剂量爬坡试验
在起始剂量到最大剂量间,一系列包括升降或保留剂量的序贯决策过程,来找到最大耐受剂量(Maximum Tolerated Dose, MTD)。(常见经典单药观察DLT)
一个好的剂量爬坡试验的设计原则:
① 有限样本量,准确找到 MTD;
② 控制疗效不足(即MTD以下)及超过耐受性(即MTD以上)接受治疗患者数量;保证有效性(即MTD)增加分配于目标剂量下的受试者比例。
剂量爬坡设计类型
贝叶斯最优区间设计, BOIN
策略
假定(λe, λd): 为在剂量水平j下提前设定的毒性概率区间,λd>λe>0 ;
第j剂量组,毒性概率的点估计为
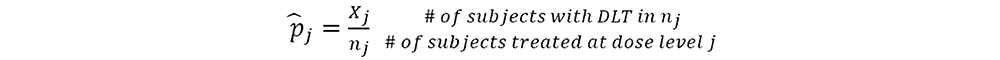
如果p ̂_j≤λ_e,增加到剂量水平j+1;
如果p ̂_j∈(λe,λd ),保持当前剂量水平j;
如果p ̂_j≥λ_d,降低到剂量水平j-1.
毒性概率区间界值的计算:核心思想
计算的(λ_e, λ_d)使得选择剂量组犯错概率最小
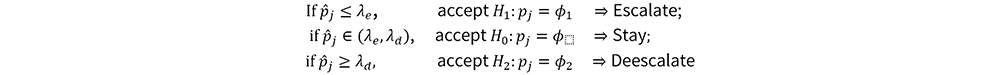
Pj: 在剂量水平j下真实毒性概率 ;
ϕ_∶ 目标毒性概率
ϕ_1: 低毒性概率(underdosing toxicity rate): 意味着未达到合适治疗剂量
ϕ_2: 高毒性概率(overdosing toxicity rate) : 意味着过毒
毒性概率区间界值的计算:最优化区间
假设在剂量水平j下各个假设先验分布都相等即:P(H0j )=P(H1j )=P(H2j );意味着π_0j= π_1j = π2j,得到使犯错概率最小的区间界值(λe ,λd)为:
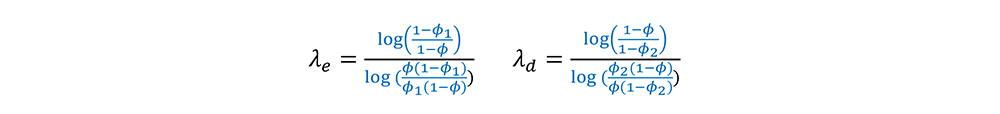
区间界值(λe,λd)只与ϕ ,ϕ1, ϕ2有关,与剂量水平,入组人数均无关。
关于ϕ_1, ϕ_2的设置
1)避免ϕ_1, ϕ_2值与ϕ_非常接近,因为I期试验的样本量很小,会导致检验效能很低
2)建议ϕ_1=(1-c)ϕ_ 和 ϕ_2=(1+c)ϕ_ 其中c∈(0.3,0.5)
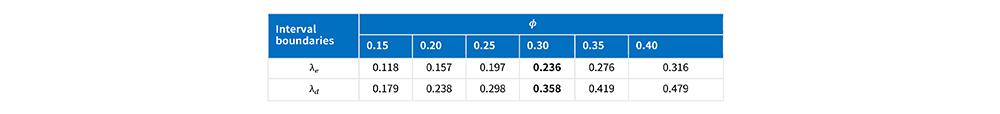
3)默认值ϕ_1=0.6ϕ_ ϕ_2=1.4ϕ_ 当ϕ_1=0.6ϕ_, ϕ_2=1.4ϕ_,不同目标毒性概率ϕ_下,最优化区间界值为:
试验终止条件:
-没有找到MTD:最低剂量组因毒性过大而被排除
-找到MTD:
1) 当前剂量水平接受治疗受试者人数达到预定最大值时,且根据决策表是维持当前剂量水平;
2) 达到预先设定的最大样本量
软件操作:
国外网址:https://www.trialdesign.org/
国内网址:http://trialdesign.cn/#newsSection
BOIN设计不是仅仅用软件来计算数字,对于统计师而言,还有一些设计要点需要考虑。在设计之初需要设定目标毒性率,而目标毒性率需要和申办方医学及研究者一起探讨得出。过高的目标毒性率在安全性上通不过,过低则会让申办方认为药物的疗效达不到。
设计要点:
-设定目标毒性率
-设定Cohort size (常设为3)和Cohort个数(合理设计)
-设定单个剂量组最大可评估例数(如设为9,12)
-剂量组个数。确定探索剂量水平考虑是否需要嵌入加速滴定
执行要点:
-伦理问题
-时间、成本和收益
-剂量组添加和变更
-升降剂量决策的执行流程
TOPIC 3 BOIN设计的应用及考量

韩海雄博士
有临医药首席医学官
自2011年FDA获批的药物中,出现多个剂量选择有待优化的药物。与细胞毒类药物的毒性不同,非细胞毒药物通常是每天服用,呈现连续毒性,因此对毒性容忍度可能不同,依据毒性特点及临床需求等特点,需要更灵活的方法对毒性的容忍度进行灵活的设计。BOIN设计满足了临床试验所需的准确性(快速精准的找到MTD)、安全性(尽量减少暴露在高于MTD剂量组的受试者例数,避免选择过毒的剂量做MTD)、有效性(将尽量多的受试者分配到有效剂量组)以及可操作性(设计灵活、操作简单,规则明确)等需求。
医学考量1 BOIN设计适合哪些药物早期试验使用
医学考量2 采用BOIN设计,对于FIH设计,如何定义Target toxicity rate for the MTD的发生率?
医学考量3 Corhort一般采用3,是否可以采用其他如2,4?
医学考量4 Corhort为3,当实际入组数为5例受试者是否可以做升剂量决策?
灵魂拷问:
Q1: BOIN设计在中国临床实践过程中面临的机遇和挑战是什么? 临床试验各个部门如何通力合作执行好BOIN设计的项目?
Answer:机遇与挑战并存,从挑战和现实需求(临床药物类型,药物安全性、疗效以及临床试验中的操作问题)中不断找到创新方法,为加速推动新药上市创造新机遇。虽然目前因惯性思维,3+3设计更为深入人心,但BOIN的优势明显优于3+3,并且也得到了FDA和CDE监管机构的认可。如果大家能真正了解,也会更容易接受并推广。希望尽快把BOIN设计从统计圈拓展到医学、运营、药理领域,更大范围地推广和普及。
Q2: BOIN设计里面的“cohort”是指每个剂量组设定的最少入组人数吗?
Answer:三例其实是一个下限,一般可多不可少,如果少于三例会影响决策的稳健性。多于三例,经济性就会变弱。建议第一次入组三例。因为如果例数太少会导致可评估的患者数低,分母太小,决策时无法提供很好的依据。 但从伦理层面考虑,无法保证每次正好3例,超出的患者也需要被治疗。例如当实际临床只缺一例患者,但结果同时来了2例时,3+3设计就不适用了。如果使用更具弹性和可操作性的BOIN设计,哪怕4例甚至5例也可以满足。第二从实际操作层面来讲, 3+3设计要求的三例是可评估的设置者,但实际操作中无法真正保证从而影响决策。可BOIN设计完全不用受制于特定数量,理论上只要在当前剂量上观察DLT率,就能进行决策。
Q3: BOIN设计,一个剂量组DLT不可评估,脱落的人数占多少比例,是否有要求?
Answer:BOIN设计只要是能够计算当前剂量下的观察DLT率,就可以决策。所以如果出现DLT不可评估并不会影响决策,也没有脱落的比例限定。但最好不要脱落,因为脱落太多就意味 DLT率估计的方差和执行区间可能会波动很大,很可能导致后续入组受试者时,最后还得降下来,影响试验效率。
Q4:对于DLT率的计算,分母可评估数是指用药患者对吗?是否考虑患者是否完成观察期呢?
Answer:是指可评估患者数,如果 DLT可评估,应该是给药并且完成观察期,作为可评估患者数。建议在方案中定义一个DLT分析集,这块也要留意做一些规定。尽量应该给药足够,才能更好地完成观察期。
Q5: 高于设定的target rate(35%)为什么当时没有降低剂量,而是继续保持剂量呢?
Answer:剂量升降是由target rate的上下限决定,而不是target rate。当前剂量组和MTD相对接近时,由于当前剂量组可评估受试者数少的情况下可能得到DLT率高于35%(可能是由于随机导致的),所以建议用当前剂量组的DLT率与target rate计算的上限和下限相比较,来判断是否是需要升降剂量。
Q6:请问BOIN设计中,关于剂量,特别是升和降剂量的剂量一般设置多少合适呢?升100%?降50%?
Answer:这个属于递增剂量的选择问题,需要综合考虑安全性,起始剂量,目标剂量,剂量组数和制剂规格。递增剂量的选择目的:寻找“安全剂量范围”和最大耐受剂量(maximum tolerated dose,MTD),在最大起始剂量至最高剂量之间设若干组,对于毒性较小者可少设几个组,对于作用较强、毒性较大者,则应缩小剂距多设几个组。
综合考虑起始剂量与药理学活性剂量和毒性剂量之间的距离、毒代和药代动力学特征等因素,制定剂量递增方案,一般采用改良Fibonacci法(固定百分数递增法),第1剂量MRSD,第2剂量较第1剂量多一倍,第3剂量比第2剂量多67%、第4剂量比第三剂量多50%、第5剂量比第四剂量多40%,以后的各级均应比上一级多33%。即1n、2n、3.3n、5n、7n,此后以33%递增。研究者应该根据临床前实验数据,来决定他所要采用的药物递增方式,如可以用log增量或使用常数增量。
剂量递增采用的基本原则是剂量间隔先大后小。