



 有临
有临
 2023.07.17
2023.07.17
 1941
1941

无论在临床前研究还是临床研究,生物分析都扮演着重要的角色。6月28日晚,有临医药携手CMAC成功举办《追踪热点,解析生物分析新风向》直播,由有临医药生物分析运营总监朱帮杰博士主持,特邀三位行业专家:华中科技大学黄建耿教授、武汉宏韧化药生物分析总监陈桂英博士及武汉宏韧生物制品生物分析总监郎士伟博士,几位专家分别从不同视角就大、小分子新药研究中,关于生物分析方面的问题作相关专题分享。

TOPIC 1 多肽类药物生物分析与 非临床PK研究的主要考量

黄建耿博士
华中科技大学教授
多肽类药物涵盖的治疗领域广泛,包括抗肿瘤、抗感染、免疫和糖尿病等。目前上市的多肽类药物有80余种,其中150余个在临床研究阶段,400~600 个在非临床研究阶段。多肽药物生理活性强、用药剂量低,但由于复杂的生物基质带来诸多临床开发面临的生物分析方法的挑战:如溶解度差、灵敏度低、选择性差、回收率低、基质效应、残留、稳定性、非特异性结合等问题。黄教授理论结合实践,深入浅出地为观众讲解了多肽类药物的开发策略和注意事项、非临床动物体内药代动力学特征、PK/PD模型研究及经典案例分享。
TIPS
1. 多肽药物生物分析
色谱条件:填料孔径、色谱峰形、残留效应 质谱条件:产物离子选择、灵敏度 样品处理:溶解度、吸附、回收率、基质效应、选择性
2. 多肽药物非临床DMPK研究
体外、体内非临床DMPK研究内容根据适应症、给药途径等调整 非临床研究若采用猴进行试验,也可考虑免疫原性
TOPIC 2 化学创新药临床生物分析研究要点

陈桂英博士
武汉宏韧医药化药临床生物分析部门总监
陈博针对小分子新药生物分析过程中,包括待测物的选择、生物基质选择、线性范围确认、稳定性等八大关注要点进行系统归纳和阐述,并结合三个实操案例进一步深度讲解,涵盖了新药生物分析的方方面面。
各临床试验阶段生物分析的特点
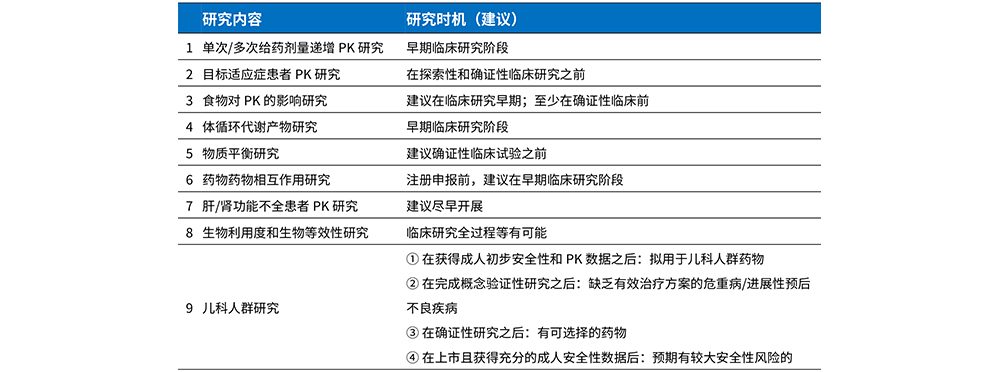
TIPS
-对药物的溶解度、化学稳定性、药物非临床药代动力学特征及分析检测的特点进行全面了解,做到有的放矢
-早期临床阶段,由于研药物在人体内的药代特征的不确定性,其生物分析的难度增大
-首次人体试验的获得的样品非常重要,特别是对于检验方法的线性范围是否合适、ISR是否通过(是否受代谢产物的影响)等具有非常重要的参考价值
-创新药临床研究周期长,对分析方法的稳健性要求高
-各环节的过程管理尤为重要
TOPIC 3 细胞和基因治疗药物的生物分析策略

郎士伟博士
武汉宏韧医药生物制品临床生物分析部门总监
近期细胞治疗和基因治疗的兴起,为多种疾病提供了革命性的解决方案,已成为目前研发的热点,郎博士分享了当下非常热门的CGT药物的若干检测方法及案例分析,帮我们理清了CGT药物研发的来龙去脉,以及该类药物临床阶段使用到的各种检测手段,并对一些检测的难点和关键点进行深入解读。
CGT生物分析
-PK和分布:细胞(流式细胞法)、转基因拷贝(qPCR/ddPCR)、LBA、LC/MS、IHC...
-免疫原性:外源表达蛋白、载体免疫原性、细胞整体免疫原性、人类白细胞抗原(HLA)...
-生物标志物:细胞因子、趋化因子、黏附因子、免疫分型... 安全性指标:RCL慢病毒基因编辑的细胞制品、病毒脱落
-免疫组化:入组筛选等
CGT分析
-分析物复杂:细胞制品,载体
-分析方法多样:qPCR,流式细胞术,LBA,色谱(HPLC,LCMS).
-稳定性:细胞(PBMC),冻存
TIPS
1. 划时代的新兴医疗手段
CGT治疗提供了一种全新医疗思路。发展迅速,前景广阔,被广泛应用于遗传疾病、晚期血液疾病、癌症、免疫性疾病、感染 性疾病等病症的临床研究中,展现出可观的临床应用价值。
2. CGT产品更高的复杂度为生物分析检测带来新的挑战
-传统药物组分单一,而CGT本身复杂度高,一个细胞包含蛋白或核酸等物质达万种
-CGT治疗产品可能受到微环境的影响,并随时间发生变化;基因治疗产品能否有效的递送并发挥功能,细胞“活”的特性会迁移到不同组织器官,追踪分布和聚留具有挑战
-传统的LC-MS或单独的配体结合实验,不足以支持CGT产品的分析
-qPCR、流式细胞、配体结合试验、IHC、测序等多平台分析检测方法助力细胞制品的研发
相关精彩内容请移步至
有临视频号,观看本期回放

灵魂拷问:(如有其他想了解的专业问题,欢迎随时给我们留言)
Q1: 多肽药物目前解决残留的策略都有哪些?其DMPK研究内容与化学药物是否相似?
Answer:1. 多肽药物在质谱分析领域,残留确实是很常见的问题。首先考虑改变色谱条件、控制线性范围。其次,调整进样序列也是措施之一,如真实样品中间加空白样品。但如有条件,可采用抗吸附的管路,硬件条件改善有时效果较好。
2. 多肽和化学药物DMPK研究有些不同,多肽药物主要通过皮下注射、肌肉注射给药,Caco-2细胞的渗透性以及肠道转运体可以不开展。此外,CYP酶表型在多肽药物领域一般可以不开展,主要代谢酶比较清晰。但在代谢物鉴定和物质平衡方面,由于检测方法难度大存在较大挑战,目前多采用放射性标记方法进行测定。但考虑到多肽在体内降解成氨基酸之后,可能会被内源性来使用,多肽药物PK参数需要进行科学性方面的解释。
Q2: 创新药研究中,不同试验数据用于一个研究目的时,是否需要开展交叉验证工作?
Answer:通常在创新药研究中,涉及不同试验用于同样研究目的,特别是在不同实验室完成检测或利用不同线性范围去完成的检测,往往是需要开展必要的交叉验证。确保不同试验研究数据的准确性,才能用于后续研究。
Q3: 病毒类载体基因治疗(如AAV)免疫原性检测需要注意什么?
Answer:病毒类性载体免疫原性检查非常复杂,包括两部分:病毒本身和外源表达蛋白,检测时两个都要考虑。除体液免疫,且与其他蛋白药物相比还要检测细胞免疫。细胞免疫需要注意样本的稳定性;外源蛋白免疫性可能有强有弱,风险不同。外源蛋白本身如非人体原有,可能是风险偏高产品,需要注意。对于基因表达载体本身的分析和检测,如结合抗体和中和抗体,需要明确目的。一般来说,这种载体并非简单的评价免疫原性。基因治疗载体比如AVV,主要目的是为评估受试者是否能接受治疗。比如,受试者本身有很多AVV抗体,那再给药就会无效。所以,有时候它是被作为临床筛选的分析和检测。检测方式不能只看实验室数据,而是需要得到检测灵敏度和检测方法与其他文献报道的有比较性。比如,实验室结论是滴度200以上的受试者就不能入组,那如果这仅是实验室做的且灵敏度比别人高,即便这个实验室的方法建立得更好却不能达到目的,也是个问题。
Q4:创新药临床生物分析研究存在那些难点?
Answer:创新药在不同临床研究阶段面临的挑战也不同。例如首次人体试验阶段,由于对药物及其代谢产物在人体内的暴露量及暴露形式的不确定性,会给检测带来难度。例如如何选择合适的现行范围,以及宽剂量下的宽线性范围引起的残留、响应饱和等问题。而后期临床研究阶段往往需要关注合并用药的影响,游离药物的检测(如肝肾功能损伤受试者PK)。此外,当涉及除血样外的其他生物基质(如尿液、粪便、脑脊液、痰液、唾液等)的检测时,也由不同类型生物基质的成分组成,药物浓度分布以及采集过程,从而确保所建立的方法可以准确定量生物样本中药物或代谢产物的浓度。
为感谢所有新老朋友
对有临医学的支持
我们将抽取20位幸运读者
送出精美礼品,聊表心意
欢迎大家扫码参与抽奖
