



 有临
有临
 2023.12.15
2023.12.15
 1312
1312
今天是“世界强化免疫日”,这是1988年第41届世界卫生组织大会为消灭脊髓灰质炎(又称小儿麻痹症)而设立的。50年代末至60年代期间,仅中国每年就有高达1 ~ 4万多人感染脊髓灰质炎,导致终身残疾,甚至因病致死!
在常规免疫的基础上增加免疫接种的频次即为强化免疫。1993年至2000年,中国对脊髓灰质炎采取了强化免疫措施,针对四岁及以下儿童开展了7次14轮的加服含脊髓灰质炎减毒活疫苗的糖丸,并于2000年经世界卫生组织证实,实现了中国无脊髓灰质炎的重大突破。面对如此巨大的成果,我们不禁畅想,如果有疫苗可以预防肿瘤,使得人们不必再忍受癌症带来的病痛,该有多好!
然而,虽然现在很多科学家致力于研发既能预防肿瘤,又可治疗肿瘤的疫苗,但因为癌症的发病原因不同于微生物,如细菌和病毒等外源性感染疾病,给实现肿瘤疫苗带来了极大挑战。
肿瘤的产生是由于人体自身的细胞发生了变异,其原因可能是外源性感染、物理辐射或化学性物质损伤等因素,也可能是因为与年龄相关的免疫系统退化。目前已知约15%的癌症是因病毒感染引起细胞变异导致的,对此类癌症的肿瘤疫苗的设计,可通过预防病毒感染来阻止肿瘤的发生。例如,有些宫颈癌患者由于早期感染了人乳头状瘤病毒(HPV),宫颈癌疫苗就专门针对预防感染HPV来设计。类似地,患有乙型病毒性肝炎(简称乙肝)的人易罹患肝癌,但当注射了预防乙肝的疫苗后,就能阻断乙肝引起的肝癌。但这类针对病毒引起癌症的疫苗,仅可阻止因感染导致的癌症,而对因其他原因产生的癌症却无能为力。例如,乙肝疫苗虽然可以预防因乙肝造成的肝癌,却无法阻止由于酗酒导致肝癌发生。
所以,科学家们需要设计出一种可针对肿瘤细胞变异因子的疫苗,如此,无论因何种原因引发细胞变异时,都能激活免疫系统,刺激免疫反应杀死全身的隐匿性病灶,防止它们大量增殖导致癌症发生。这样的疫苗还能在确诊癌症因何种细胞变异导致后,应用于治疗癌症,并产生免疫系统记忆。当这种细胞变异再次发生,即癌症复发时,免疫系统可及时识别,消灭癌症复发于萌芽状态。因此可以理解,肿瘤疫苗的设计核心是将肿瘤细胞变异的那部分“带入”疫苗中,使得免疫系统在接触过疫苗后,能够识别出带有变异成分的肿瘤细胞,并启动免疫系统的杀伤功能,靶向杀死肿瘤细胞。
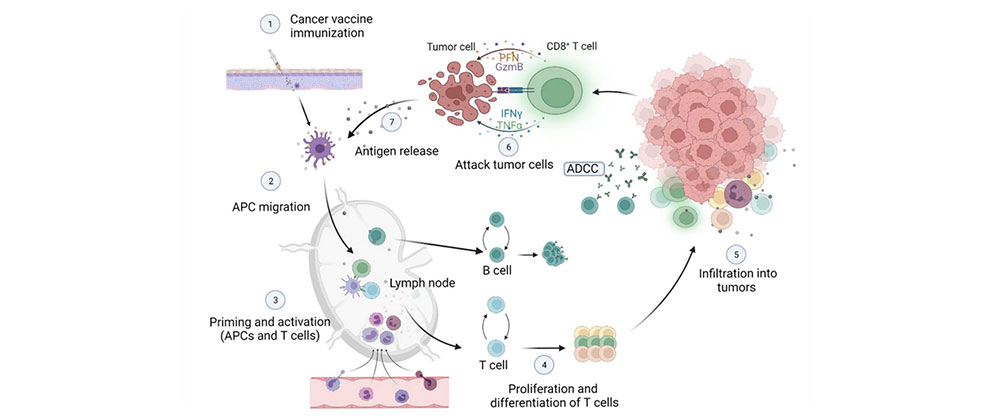
说明:①在施用肿瘤疫苗后,②树突细胞(DC)摄取并处理肿瘤抗原,然后通过抗原呈递细胞(APC)将其呈现给主要组织相容性符合体(MHC II或MHC I)。③抗原负载的DC迁移到淋巴结以招募和激活免疫细胞,并促进④记忆B细胞和浆细胞的生成。⑤活化的B细胞通过ADCC促进肿瘤凋亡。激活的T细胞增殖并分化为记忆T细胞和效应T细胞。效应 T细胞到达肿瘤微环境(tumor micro environment, TME),直接杀死肿瘤细胞或诱导肿瘤细胞凋亡。⑥免疫原性死亡肿瘤细胞可以⑦释放肿瘤相关抗原(tumor associated antigens, TAA)和危险信号分子,以在后续循环中不断增加免疫反应的深度和广度。
肿瘤疫苗设计中需要被“带入”疫苗的是肿瘤细胞变异特有的部分,被称作“抗原”。在脊髓灰质炎疫苗(“糖丸”)里的抗原是失去活性的病毒,在疫苗中使用时既不会导致疾病,还能让免疫系统识别导致疾病的“有害物质”并及时对有害物质发起进攻。但肿瘤抗原的选择要比“糖丸”类抗病毒疫苗中的病毒抗原的选择困难得多,因为它是来自“自己”的细胞。
一般获得肿瘤抗原的途径有:肿瘤组织活检、计算机分析、跨肿瘤类型的特征汇总等。所有肿瘤的抗原可归为两大类,肿瘤相关抗原(tumor-associated antigens, TAAs)和肿瘤特异抗原(tumor-specific antigens, TSAs)。理论上,使用TSAs是肿瘤疫苗设计的最佳方案,因为它仅可能来自肿瘤细胞,正常细胞中不会存在。对于免疫系统来说,它就像病毒的外源性抗原。但遗憾的是,目前为止尚未发现任一TSAs。所以,目前肿瘤疫苗研究中使用的都是TAAs,较之正常细胞,它在肿瘤细胞中表达得更多(overexpression)。或者在细胞的正常发展阶段不会出现(differentiation and lineage-specific),又或者只在生殖系统才会出现(cancer-germline / cancer testis),因此,以 TAAs 作为肿瘤疫苗的抗原,不仅可引起有效的免疫反应清除癌细胞,成功诱发免疫反应,也会攻击同样带有TAAs 的正常细胞,而引起自免疫的风险。
虽然寻找合适的肿瘤抗原仅是肿瘤疫苗研发的第一个挑战,科学家们还需要使用多种方法将抗原整合在疫苗中,并确保可以运送到肿瘤所在处。目前在试验中的肿瘤疫苗大致有:全细胞疫苗、多肽疫苗、病毒载体疫苗及mRNA疫苗等。第一款真正用于治疗晚期前列腺癌的治疗性癌症疫苗,于2010年获得批准——Provenge / sipuleucel-T(普列威)。不过,目前肿瘤疫苗的临床研究才刚刚起步,自Provenge / sipuleucel-T获批后,近十年来未见新的治疗性肿瘤疫苗取得重大进展。尽管有些已进入II期临床的肿瘤疫苗显示出了良好的应用前景,但自身免疫性不良反应的发生,抗原的递送不足及肿瘤处于免疫抑制性“冷肿瘤”的微环境等不利因素的存在;加之肿瘤疫苗的生产、贮存等苛刻条件,以及肿瘤治疗其他领域取得的成绩等,都会对肿瘤疫苗研发的热情和投入带来冲击。因此可以说,肿瘤疫苗的研发任重而道远!
幸而科学家始终坚持不懈地探索,2023年诺贝尔生理学或医学奖获得者卡塔琳·考里科和德鲁·韦斯曼,在信使核糖核酸(mRNA)研究上的突破性发现,将有助于疫苗开发达到前所未有的速度和高度,对肿瘤疫苗的研究更是开辟了新的路径。可以期待有一天,癌症会像脊髓灰质炎一样,在强化免疫中逐渐被消灭。
参考文献:
1.Hausen,H. zur. Viruses in Human Cancers. Science (1991) doi: 10. 1126/ science. 1659743.
2.Ref. Jian Liu, et al. Cancer vaccines as promising immuno-therapeutics: platforms and current progressJ Hematol Oncol (2022)15:28.
3.Matthew J. Lin , Judit Svensson-Arvelund, Gabrielle S. Lubitz , 等。Cancer vaccines: the next immunotherapy frontier(2022)Nature Cancer VOL 3:911–926 /www.nature.com/natcancer
4.范昊,葛祥伟,周鑫,等。肺癌疫苗研究进展(2023)中国肺癌杂志VOL 29:692-700/ DOI: 10.3779/j.issn.1009-3419.2023.106.19