



 有临
有临
 2024.02.07
2024.02.07
 2754
2754
在过去的三十年里,肿瘤临床试验中基于影像的肿瘤特异性反应标准对疗效反应进行评估应用中存在一些分歧,2009年,修订后的RECIST1.1(实体瘤反应评估标准)被开发出来,以解决先前应用标准(如WHO和RECIST的初始版本)的缺陷和局限性。主要变化包括要评估的靶病灶数量,总数从最多10个减少到最多5个(每个器官从5个减少到最多2个)。对于可测量病灶选做靶病灶的要求是非淋巴结病灶最长径至少为10mm,病理性淋巴结的垂直短径至少为15mm。在疾病进展方面,除了之前规定的靶病灶总和(SOD)需要增加20%以外,绝对值还需增加5mm,以避免当SOD非常小时,过度判定PD(疾病进展)。最后在新病灶评估中纳入了FDG-PETCT检查。
RECIST1.1的准确应用让治疗后的评估变得标准化,然而如果应用不当,可能会出现错误的放射学解释,对患者管理产生负面影响。
在我们的机构,我们使用自动化支持软件mint lesion® (Mint Medical, 德国海德堡)用于评估治疗反应。通过使用圆形测量工具来测量病变,从而最精确地识别非淋巴结靶病灶的最长径和淋巴结病灶的最长垂直短径,并将所有测量的值加入到靶病灶总和中进行计算。
在本文中,我们展示了与RECIST1.1相关的一系列陷阱,并提供了如何在临床实践中避免这些陷阱的实用技巧。
RECIST1.1临床实践中最常见的错误主要包括:测量不准确,病灶定义不恰当、成像技术不合格,具体分为以下10点:
01. 预防用疫苗发展史 不合格的靶病灶(数量、大小和假性病灶)
尽管RECIST1.1中明确定义了要测量的靶病灶数量和大小,但实际工作中不可避免地会出现一些不合格的病变,例如错误地纳入太小的病灶或非转移性病灶(图1A/B),或者将良性病变选为靶病灶,例如基线纳入靶病灶的血管瘤和良性囊性病变会导致出现错误的评估结论。
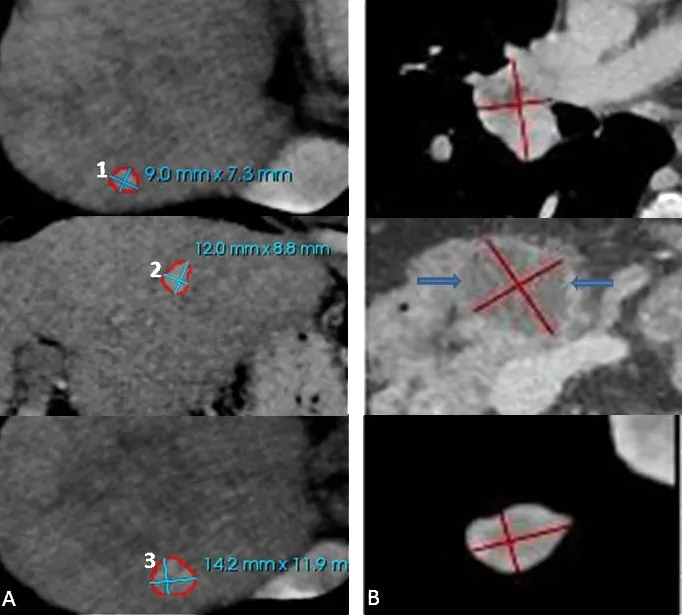
图1:BOIN设计流程图
图1:49岁男性,肾透明细胞癌多发转移。A:三个肝内转移瘤有两个被选做靶病灶,第1个病灶的最长直径为9mm,不符合RECIST1.1靶病灶的入选标准。B:两个肺内转移瘤和一个胰腺囊性病变(中间图像蓝色箭头)选为靶病灶。后续随访证明胰腺囊性病变为IPMN(胰腺导管内乳头状粘液瘤)。注意:胰腺中的肾透明细胞癌转移瘤一般都为富血供肿瘤,而非囊性病灶。
提示1a:严格遵守RECIST1.1关于靶病灶选择、测量的要求,每个器官最多两个靶病灶,总共五个病灶;非淋巴结病灶最长径为10mm,淋巴结病灶垂直短径为15mm。
提示1b:基线纳入的假病灶,不应在后续访视中计入靶病灶总和,因为这会导致疗效评估的偏倚。当任何病变被证明是非恶性时,必须重新创建一个新的基线。
02. 将形状不规则或不可重复测量的病灶纳入靶病灶
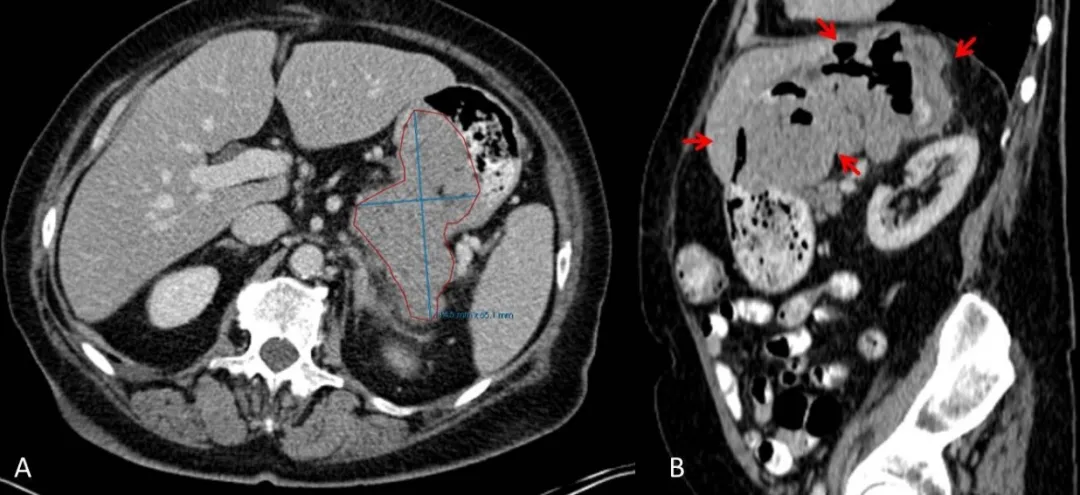
图2:52岁女性,胃间质瘤。A:横轴位图像显示胃内病灶的测量值,但这并不能反映病灶的真实大小,病灶的大小很大程度上取决于胃的充盈状态(B:矢状位图像显示的肿瘤范围,红色箭头)。
提示2:空腔脏器的原发性肿瘤不应选做靶病灶,因为这些病灶往往因为器官的充盈状态发生改变,表现出明显的大小变化,使得病变无法准确测量。
03. 骨转移瘤
根据RECIST1.1,具有软组织成分的溶骨性病灶或混合性溶骨性病灶(图3)可以被选做靶病灶。单纯的成骨性病灶在治疗后通常在大小上不会出现任何变化,因此不符合选做靶病灶的条件。
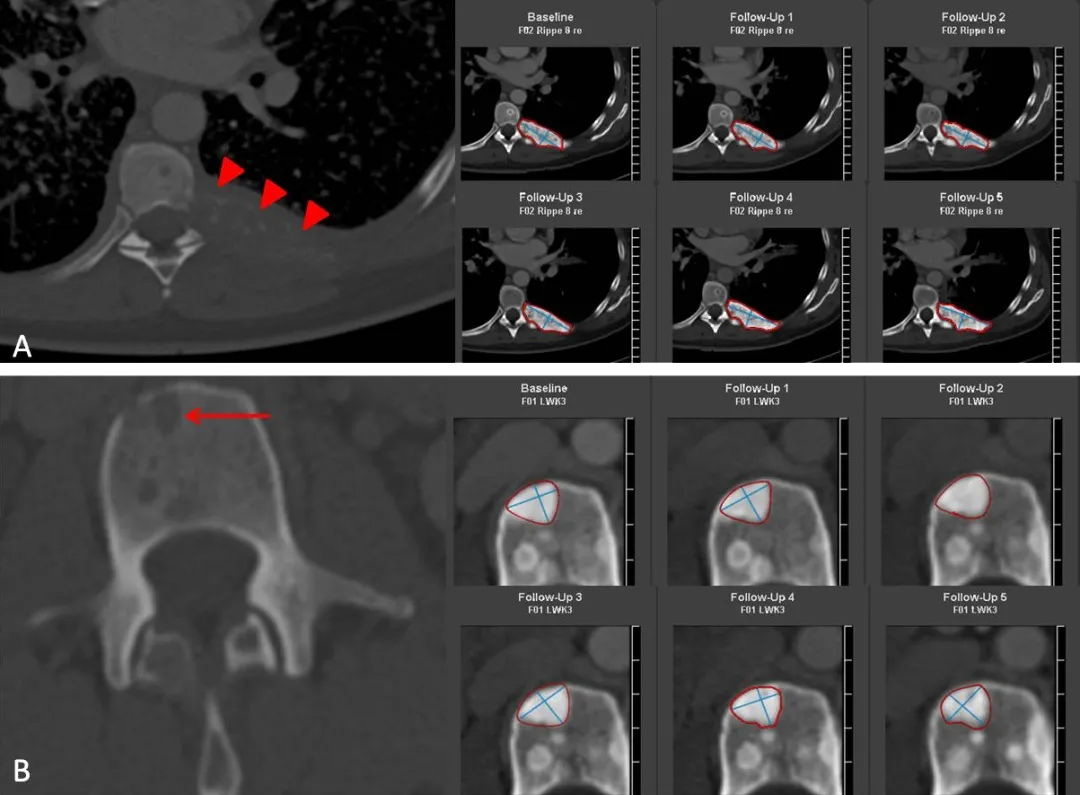
图3:59岁男性,小细胞肺癌并骨转移。A:左侧第8肋(红色箭头)和L3椎体(B,红色箭头)的溶骨性转移灶在硬化后作为靶病灶进行了测量及随访,这其实是病灶治疗后好转的表现。
提示3:请注意,根据RECIST1.1,成骨性病变属于不可测量病灶,只能作为非靶病灶进行评估。原先溶骨性病变经治疗后硬化,提示部分缓解,当病灶不含软组织成分时不应进行测量。
04. 肿瘤发生囊变/ 坏死后的评估
肿瘤治疗可能会在诱导肿瘤坏死的同时维持肿瘤的大小、甚至肿瘤直径的增大,但是肿瘤活性部分是减少的。
Choi评估标准就包括了应用对比剂后肿瘤密度的变化,用于确定疗效反应。
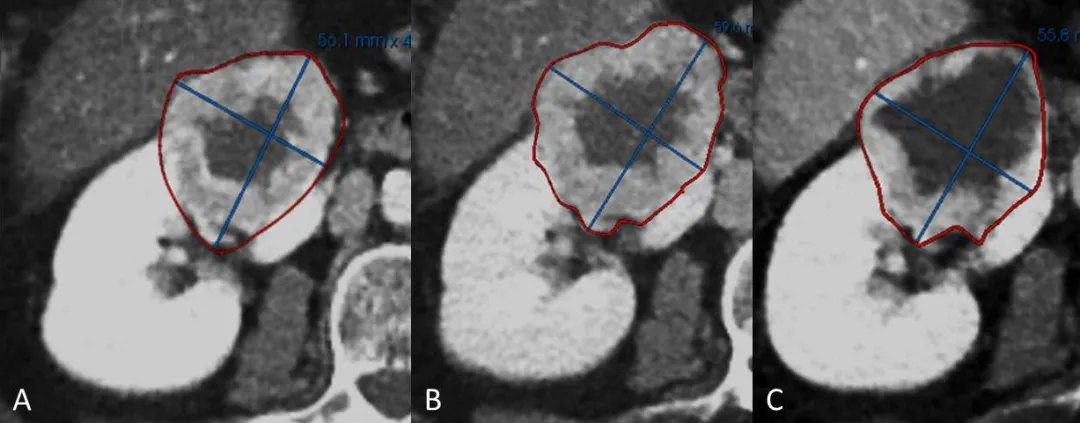
图4:49岁男性,肾细胞癌。A:基线图像显示右肾上极富血供肿瘤伴中央坏死。B、C:后续访视显示病灶的最长径没有发生变化,评估结论为SD。然而,实际上病灶中心的囊变/坏死区域较前增加,这其实表示肿瘤对靶向治疗(舒尼替尼)有良好反应。
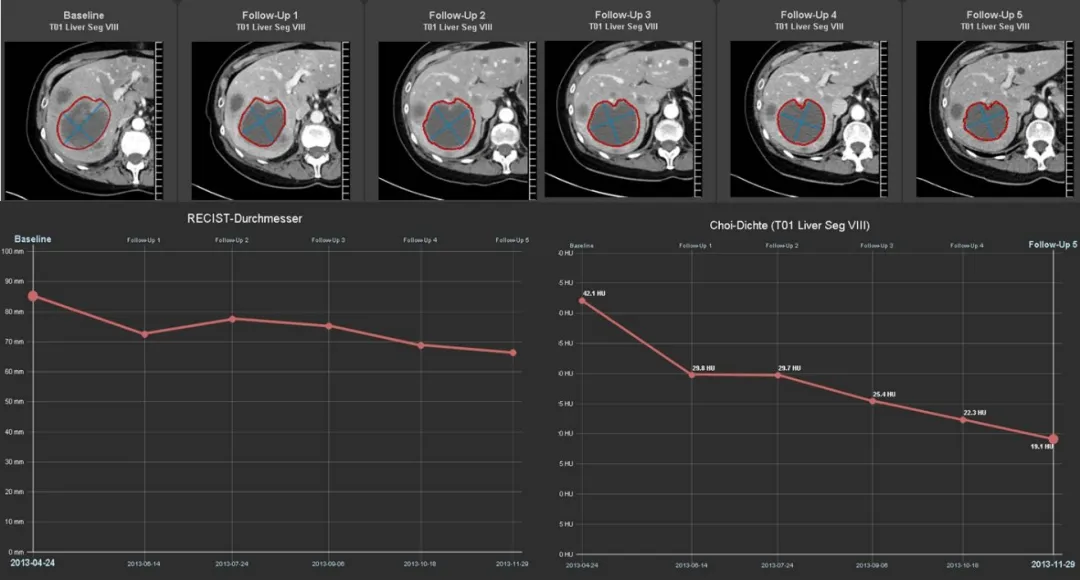
图5:52岁女性,乳腺癌合并肝转移。CT图像显示5次随访检查中肝脏靶病灶发生了坏死。折线图显示了根据Choi标准(右)的平均肿瘤衰减和根据RECIST标准(左)随时间推移肿瘤大小的变化。右折线图显示FU1访视较基线的CT值减少了15%,疗效评估达到了PR,而如果根据RECIST,疗效评估为SD。
提示4:基于大小变化的评估标准在评估新的癌症疗法时存在局限性,应用Choi标准评估靶向治疗后的囊变,可以避免RECIST1.1低估的疗效反应。
05. BOIN设计的实现工具将复发性病变视为进展性疾病
富血供肿瘤发生肝内转移时(例如类癌,GIST)通常仅在动脉期早期或动脉晚期可见,在门静脉期相对于正常肝实质衰减无太大差异,可能导致病灶无法检出。而在治疗后,在门静脉期图像上很容易看到低衰减的病变。
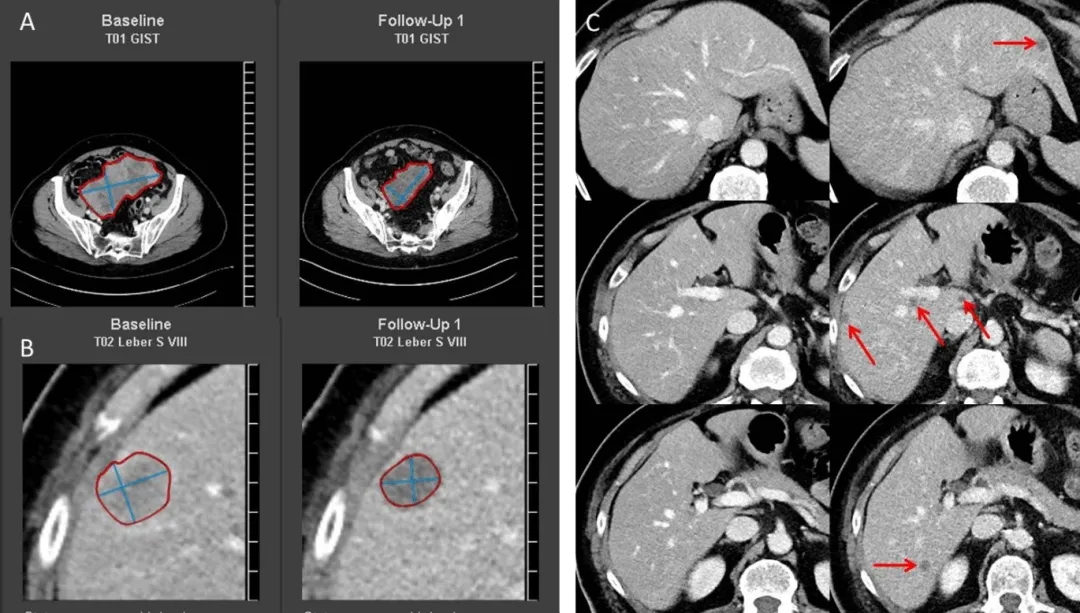
图6:74岁男性,小肠胃肠道间质瘤并肝转移。原发肿瘤(A)和肝脏转移瘤(B)在伊马替尼治疗8周后均显示出20%的消退,达到部分缓解的标准。治疗后门静脉期CT显示多个低密度肝内病变(D,红色箭头),并且基线检查(C)时未被发现。这些低密度病变不应被解释为新发病变和进展性疾病,因为它们可能在基线图像上的门静脉期难以发现,但在治疗后变得可见。
提示5:应该仔细分析治疗后CT上“新出现”的肝脏低密度病变,避免对肿瘤反应的误判,这些新发病变并不代表疾病发生进展。
06. 基线/最低点作为参考
RECIST1.1将部分缓解(PR)定义为靶病灶直径总和(SOD)较基线至少减少30%。疾病进展(PD)定义为所有靶病灶的直径总和(SOD)较最低点SOD值至少增加20%,绝对值至少增加5mm。通常情况下最低点SOD值会比基线SOD值小很多,有时候即使靶病灶SOD值小于基线,也可能会出现PD,临床经常会出现将基线和最低点混淆的情况,甚至出现仅将SOD值与上一访视点进行比较的情况。
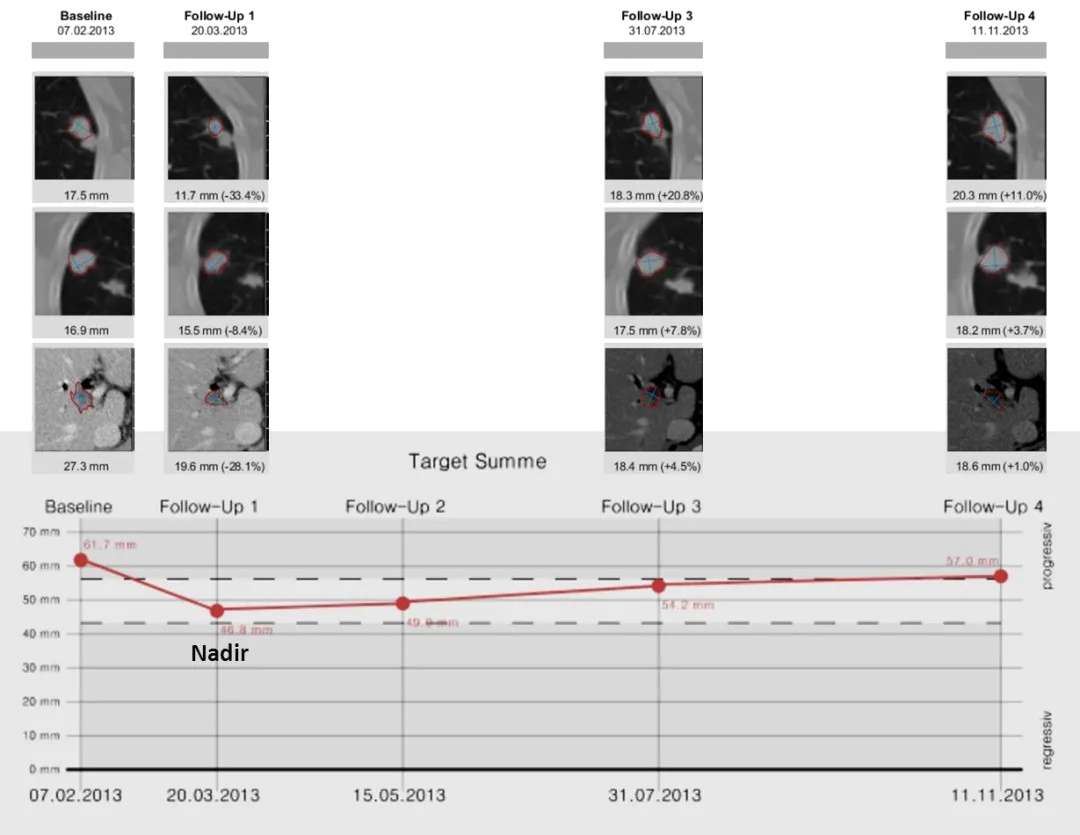
图7:47岁女性,乳腺癌并肝转移、肺转移。折线图显示了基线及后续4次访视的靶病灶SOD值的变化。如果仅将FU4与前一访视(FU3)进行比较,会得出SD的错误结论,而如果将FU4与最低点访视(FU1)进行比较则符合PD标准。
提示6:疗效反应评估不能仅仅依赖与前一次检查相比较,而是要正确地参考基线或最低点,例如:部分缓解参考值为基线、疾病进展参考值为最低点。
07. 随访中病变定义/测量不一致
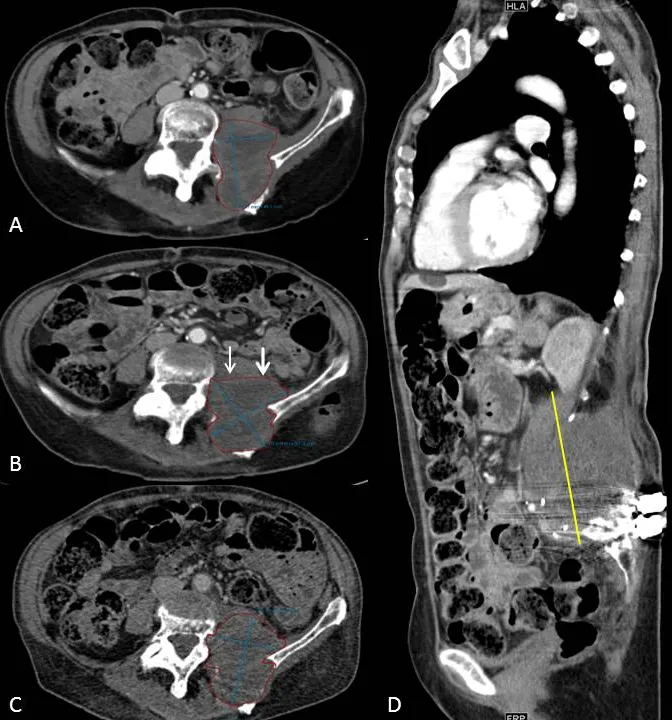
图8:34岁男性,腹膜后神经外胚层肿瘤,在整个访视期间被定义为神经鞘瘤。A:测量范围包含了左侧的部分髂腰肌。B,C:后续访视CT检查显示肿瘤上边界(白色箭头)的测量边界不一致,导致病灶最长直径测量不准确,影响疗效评估的准确性。椎旁/椎旁病变最好在矢状位进行测量(D)。
提示7:肿瘤应诊断明确,整个访视期间进行测量时肿瘤边界应保持一致,当矢状位或冠状位测量优于轴位时,应在矢状位或冠状位进行测量,并在每个访视点保持一致。
08. 时间点响应计算错误(例如反应不一致)
混合的治疗反应和靶向治疗的持续发展使癌症成为一种慢性疾病,对疾病进展的不完整评估可能导致治疗的改变,这反过来可能会给患者带来严重的后果。
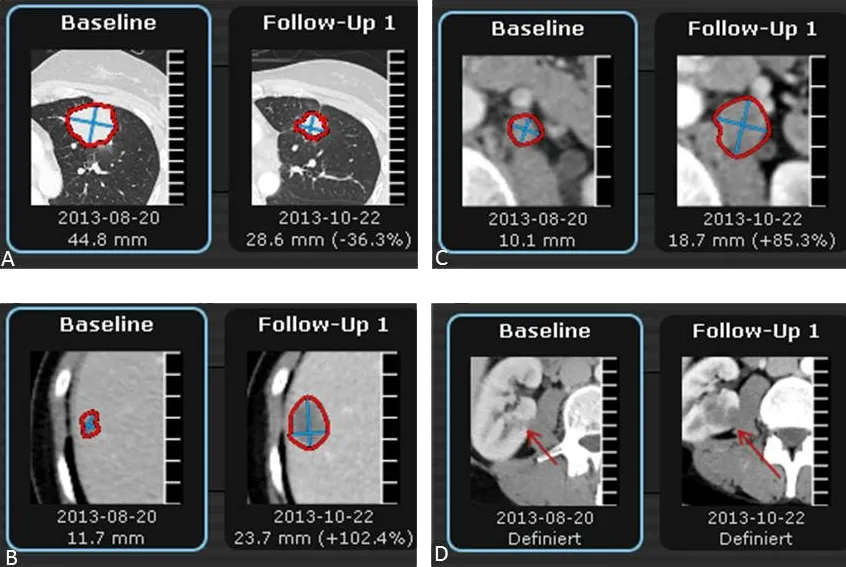
图9:52岁女性乳腺癌患者。A:肺内转移瘤后续访视达到部分缓解(PR),而肝脏(B)、腹膜后淋巴结(C)和右肾新病灶(D,红色箭头)均提示疾病进展(PD)。
提示8:在混合反应患者中,单个病变的强烈消退可能会误导医生将治疗反应评估为部分缓解,在基线时选择不同的靶病灶和非靶病灶也可能会过早地将疾病评估为进展,因此,必须牢记“大局”——关注整体肿瘤负荷,以所有靶病灶直径之和来判定治疗反应。
09.不考虑临床数据或RECIST 随访之外的其他影像学结果
虽然FDG-PET/CT的疗效评估需要更多研究去验证,但在评价疾病进展时,有时将PET-CT扫描作为CT扫描的补充检查是合理的。
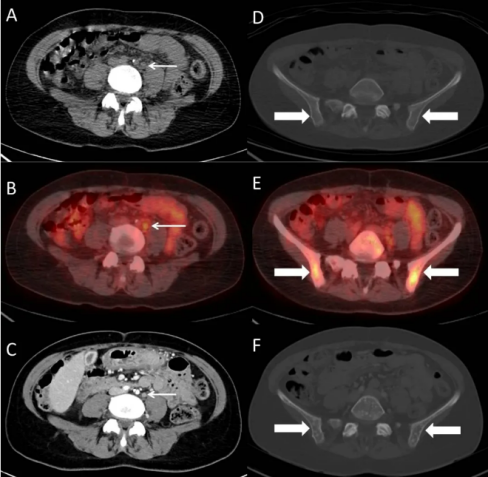
图10:一名47岁女性,黑色素瘤并骨转移和淋巴结转移。A、D:腹膜后淋巴结和骨盆在基线CT上未见异常,而(B,E)前一周的PET-CT显示淋巴结(白色箭头)和骨盆(粗箭头)均有高代谢。F:治疗3周后CT图像显示出清晰的骨转移灶。
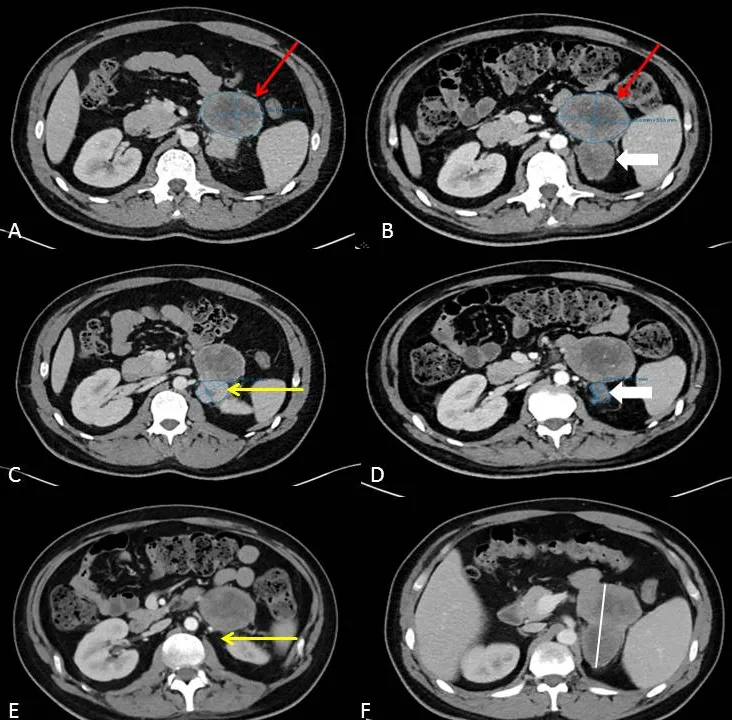
图11:33岁男性,患有两种原发性恶性肿瘤:梅克尔细胞癌和右膝关节脂肪肉瘤。A、B:左侧腹膜后(红色箭头)相对低密度的病变,是脂肪肉瘤的转移灶,由两部分组成(红色和白粗箭头)。而靠近下方另一个较明显强化的腹膜后病变(C,黄色箭头)是梅克尔细胞癌转移瘤,该病变治疗后消失(E,黄色箭头),符合完全缓解标准。然而,研究者错误的将它认为是脂肪肉瘤转移瘤的一部分,疗效判定为部分缓解,(D,粗体箭头)。F:两个没有明确分界线的融合病变应作为一个整体来测量。
提示9:结合临床信息和其他影像学结果(例如PET-CT),以避免出现错误的研究结果。但需注意PET-CT这些计划外数据的引入,如果不是常规应用或连续进行,可能会使研究者的判断产生偏差。
10. 前后不一致的模态或扫描参数
大多数实体瘤可在增强检查时采用单期相扫描,但是对于某些富血供肿瘤(例如肝细胞癌,肾细胞癌或神经内分泌肿瘤)则需要多期相扫描。
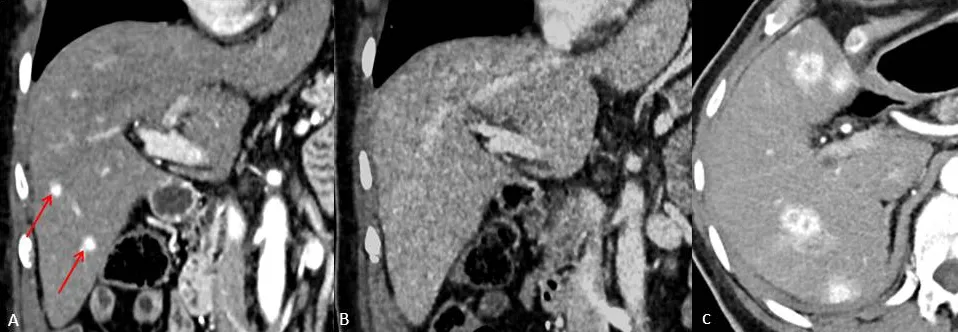
图12:63岁肾细胞癌患者。A:动脉期CT扫描显示两个显著强化的肝转移灶(红色箭头),在后续访视的门静脉期(B)的未见显示。3个月后动脉期(C)可见肝转移瘤进展。
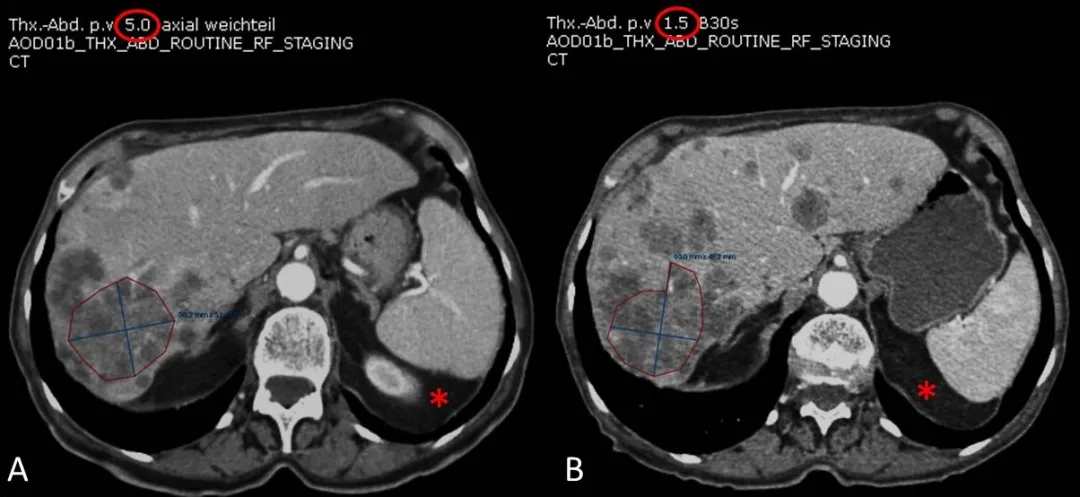
图13:一名72岁男性,结肠癌并肝转移。A:在基线CT图像上,选择了融合的肝转移瘤作为靶病灶。B:在后续访视,靶病灶在不同的解剖层面(红色星标)上进行测量,前后访视层厚也不一致(红色圆圈,5mm与1.5mm),导致出现错误的测量结果,影响疗效评估的准确性。
提示10:在所有访视期间CT扫描参数和期相保持一致,避免病变的误判;选择靶病灶也应避免选择融合病灶,即使它们是最大的病灶,而应选择可重复测量性好的较小病灶。
放射科医生应该意识到,RECIST1.1应用中即使是微小的错误也会极大地影响治疗决策。正确应用RECIST1.1标准,并充分了解可能的陷阱和局限性,可以降低患者管理的负面影响,也能提高使用RECIST 1.1进行肿瘤疗效评估时的效率。
参考文献:
M. Kekelidze1, P. Lodise2, M. Tozakidou1, M. Seitel3, G. M. Bongartz1; 1Basel/CH, 2Rome/IT, 3Heidelberg/DE,10 most frequently made mistakes with RECIST 1.1: how Radiologist can fail – and how to avoid them,10.1594/ecr2014/C-1689 https://dx.doi.org/10.1594/ecr2014/C-1689
临影医药
上海有临医药科技有限公司全资子公司,是第三方独立医学影像CRO (Independent Review Committee, IRC),为创新药物临床研究提供第三方独立影像评估服务,确保试验结果的客观性和科学性,加速临床试验、注册审批的进程,助力新药上市。
临影医药 南晓敏 撰写 / 秦维伟 审核