



 有临
有临
 2024.01.30
2024.01.30
 8754
8754
抗肿瘤药物I期临床试验若假设药物毒性和有效性随剂量的增加而单调递增,那么以探索剂量安全性为主要目的的剂量探索研究,就会以寻找研究药物在人体中的最大耐受剂量(MTD)为目标。基于此目标,各类剂量递增试验设计方法相继被提出,大致可分为三大类别:
-基于规则的设计(以传统“3+3”等为代表)
-基于模型的设计(以连续重新评估方法(CRM)等为代表)
-模型辅助设计(以BOIN设计等为代表)
模型辅助设计中的BOIN设计,全称是Bayesian Optimal Interval design,由美国德克萨斯大学MD Anderson癌症中心的袁鹰教授团队在2015年提出,是一种新的基于贝叶斯理论的I期临床试验剂量递增设计方法。该方法在2021年,获得了FDA的Fit-For-Purpose认证。
BOIN设计思路
BOIN设计思路是:找出“最优”区间(λe和λd)的设置以最小化受试者被分配到不恰当剂量上的概率为目标,也就是说使用这一组阈值能够让我们做出错误决策(包含应提升剂量时实际却维持或降低了剂量、应维持剂量时实际却升高或降低了剂量、应降低剂量时实际却维持或升高了剂量)的概率最小,即所谓的“最优”。
在贝叶斯框架下翻译成数学语言,利用无信息先验概率,可以得到最优区间的表达式λe和λd只与目标毒性概率ϕ有关。ϕ是在试验开展前由研究者、医学和申办者等根据研究药物的特点在方案中指定。在明确ϕ的前提下,统计师便可以计算出边界值λe和λd,研究者便可根据当前剂量组的剂量限制性毒性(DLT)发生率(DLT发生率=当前剂量水平出现DLT的受试者数/当前剂量水平入组的可评估受试者数)决定下一批入组受试者的剂量水平。决策流程如图一,在预设剂量组入组一个队列大小(可不经过剂量升级决策判断而入组的受试者例数)的受试者,然后在DLT观察期内,观察发生DLT的受试者例数。计算DLT发生率,然后和边界值λe和λd做比较,决定下一队列入组受试者的剂量水平。
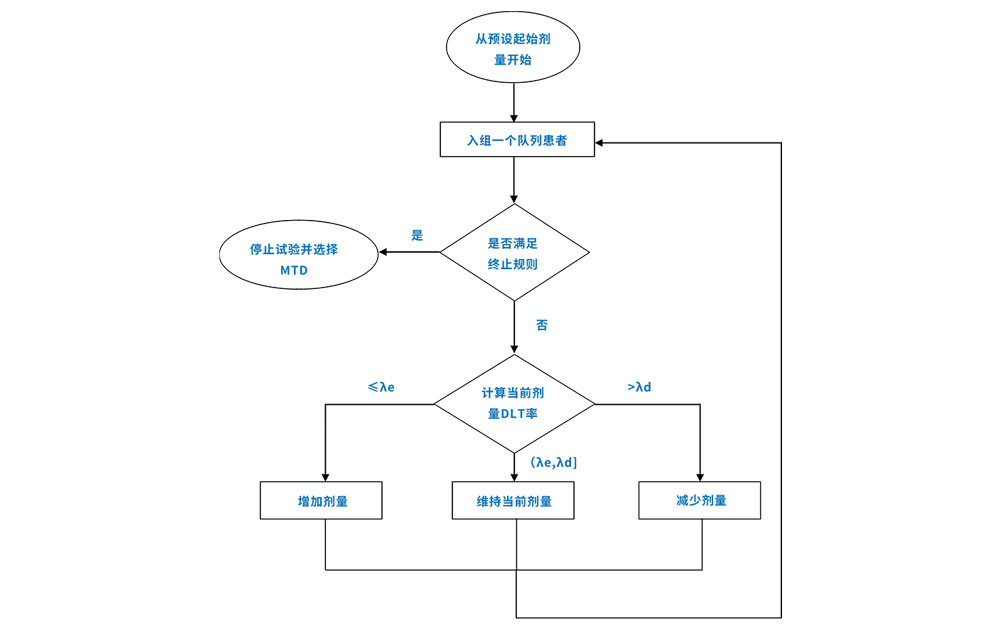
图1 BOIN设计流程图
BOIN设计的各项参数
除了上一章节提到的参数ϕ和队列大小外,在剂量递增开始前,还需确定下列BOIN设计参数:
-最大样本量N。BOIN设计所需的最大样本量需要根据待探索的剂量组数量来确定,一般建议为剂量组数量的6倍。此外,N的具体取值还需综合考虑试验成本、招募难度等因素。
-单剂量组DLT可评估受试者最大例数m,若某剂量组DLT可评估例数达到m且下一组受试者的剂量决策还是维持当前剂量则可提前结束试验。通常m可取9或12。
-剂量排除规则的阈值pE,默认值是0.95。若当前剂量组后验真实毒性概率大于ϕ的概率超过pE,则将当前及更高剂量水平从试验中排除。
BOIN设计的特点
决策透明,可事先知晓剂量变化规则
开展剂量递增试验前得到的流程图和决策表都使得统计专业人员能够与临床研究者更高效地交流,而临床研究者通过流程图和决策表就可以做出剂量转变的判断。
简便灵活,便于使用
决策评估基于的可评估受试者人数不为队列大小的整数倍(如不为3的倍数)时,BOIN设计仍可按照决策表中的可评估受试者人数的参考值进行升降剂量的决策。
统计效能优良
统计效能优于“3+3”,且受试者会有更小风险分配到过低或者过毒剂量水平。
监管机构对BOIN设计的态度
FDA:我们从www.clinicaltrials.gov/ct2/home这个网站可以搜到,有很多临床试验已经使用了BOIN设计,并且得到了FDA的官方认证。
CDE:在2020年12月31日发布的《抗肿瘤药物临床试验统计学设计指导原则(试行)》文件中提到“一些新兴的模型辅助方法如改良毒性概率区间(Modified Toxicity Probability Interval, mTPI ) 设 计 和 贝 叶 斯 最 优 区 间(Bayesian Optimal Interval, BOIN)设计,虽然基于模型而建立,但这些方法预先指定剂量递增的规则,而且易于实施,具有选择目标毒性概率和队列大小的灵活性,还具有与基于模型的设计相当的性能。”且国内也有不少团队已经在临床试验中使用了BOIN设计。
BOIN设计的实现工具
常用的BOIN设计实现工具主要有两个:① R语言的“BOIN”程序包,需要使用者会编写R语言代码对其进行调用;② Web版,用户可免费使用http://www.trialdesign.org或http://www.trialdesign.cn(中国国内站点)提供的可视化的应用程序进行BOIN设计的实现,使用者无需编写程序,只要根据实际情况填写相应的参数即可快速生成决策表格,还可以自定义场景进行试验模拟,其界面简洁、操作直观,能够一键生成多种格式报告。
此外,沿用BOIN设计的思路,衍生出了一系列新型试验设计方法,如TITE-BOIN设计(用于解决延迟毒性问题)、U-BOIN设计[用于探索最佳生物效应剂量(OBD)]、BOIN COMB设计(用于解决联合给药问题)等被陆续提出以解决更复杂的临床试验问题。
参考文献:
【1】Yuan Y , Hess K R , Hilsenbeck S G , et al. Bayesian Optimal Interval Design: A Simple and Well-Performing Design for Phase I Oncology Trials[J]. Clinical Cancer Research, 2016, 22(17):4291. 【2】Liu S , Yuan Y . Bayesian optimal interval designs for phase I clinical trials[J]. Journal of the Royal Statal Society: Series C (Applied Stats), 2015, 64. 【3】国家药品监督局,《抗肿瘤药物临床试验统计学设计指导原则(试行)》, 20201231.
审核 - 张磊
有临来雅不仅提供包括BOIN设计在内的贝叶斯方法临床试验设计与实施以及相关培训,而且可为客户定制多种灵活创新合作模式下的多方面数据管理和统计服务。如有任何相关问题,欢迎随时垂询,联系方式如下:
电话:021-56321338
邮箱:bd@union-laboratory.com
有临来雅
上海有临医药子公司,成立于 2019 年,致力于给国内外创新药、疫苗与医疗器械企业提供临床试验统计咨询、试验设计、数据管理统计分析与编程等多方面专业服务。团队由数十位来自国内外知名药企和临床 CRO,拥有平均十年左右行业经验的核心技术人员及专家构成。洞悉行业政策及标准,以客户需求为导向,不断优化迭代形成最佳实践和服务模式。适应不同业务需求,开创灵活创新的合作模式: 包括数统全方位大包服务、业务流程外包 (FSP)、战略合作、专家咨询与培训、监督管理及人员外派。为客户降本增效,加速新药研发与上市进程。