



 有临
有临
 2024.06.17
2024.06.17
 719
719
前列腺癌是男性发病率最高的癌症之一,前列腺特异性膜抗原(prostate specific membrane antibody, PSMA)作为前列腺细胞表面一类特殊受体,在腺体癌变后表达上升,是前列腺癌核素诊疗过程中的理想受体[1,2]。
PSMA作为一类穿膜蛋白,包含位于细胞内部的N端区,疏水穿膜区及位于细胞外的C端区。PSMA具有叶酸水解酶活性和谷氨酸羧肽酶活性,对C端谷氨酸肽键具有特异性,研究人员据此开发了多类PSMA小分子配体,并在其上标记放射性核素,用于前列腺癌的核素诊疗,如下图1所示[3-5]。如68Ga-PSMA-617、18F-PSMA-1007等PET探针,在原发性前列腺癌的定位、复发性前列腺癌的监控等过程中发挥着重要的作用,而与之对应的177Lu-PSMA-617,225Ac-PSMA-617等,作为靶向前列腺癌PSMA的核素内照射药物,是治疗转移性去势抵抗前列腺癌的重要手段,其中177Lu-PSMA-617在2022年3月正式获得FDA批准,商品名PLUVICTO。同时68Ga-PSMA与177Lu-PSMA作为前列腺癌放射性诊疗一体化分子,更是相辅相成,协同作用,为前列腺癌治疗方案规划、疗效评估、术后监控等过程提供信息和指导[6]。
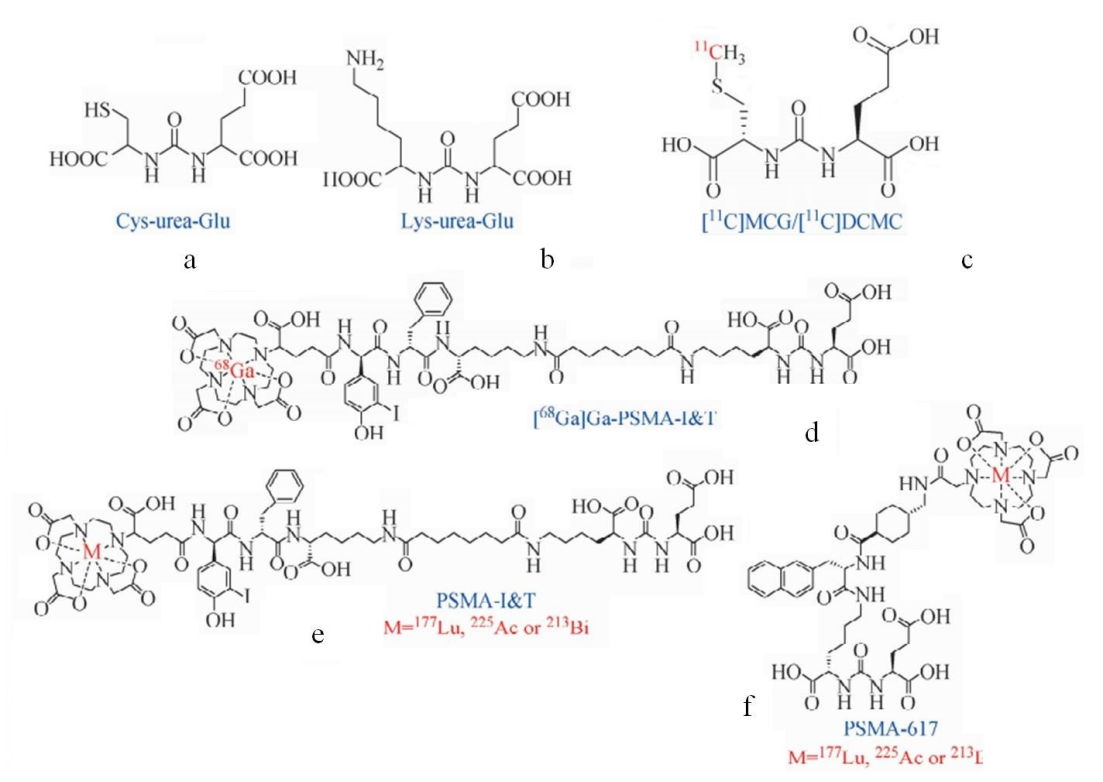
图1:基于脲基结构的PSMA靶向分子(a, b)及其衍生的PET探针与核素内照射药物(c-f)
然而,177Lu/68Ga标记的PSMA配体用于前列腺癌的诊疗一体化,始终存在令人担忧之处,其中最重要的来源之一便是由于核素差别,二者并不拥有完全相同的分子结构,导致二者的体内稳定性、ADME药代动力学行为等发生可大可小的差别。基于上述考虑,本文介绍一类拥有杂化结构的PSMA配体,即flotufolastat,中文名(妥斯特)[7]。在保留有PSMA小分子配体特征身份,即脲基Glu-urea-Lys结构,的基础上, flotufolastat在主体结构中引入了DOTA金属螯合环和氟代二叔丁基硅烷结构,这一设计赋予了flotufolastat双重核素标记的特性,如下图2所示。首先,flotufolastat可通过DOTA螯合环的配位实现放射线诊疗金属核素(如68Ga,177Lu等)的标记;其次,氟代二叔丁基硅烷允许通过18F-19F元素交换对flotufolastat标记18F,硅原子外周由二叔丁基形成的大位阻有效地保证了Si-18F标记后的稳定性,标记分子在体内外未见明显的脱氟现象。
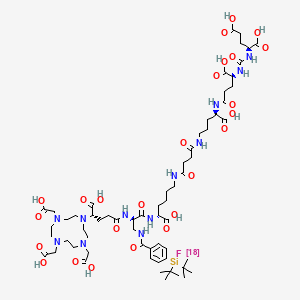

图2 18F-flotufolastat的分子结构与双核素标记示意图[7]
相较于常规的PSMA配体,flotufolastat具有更快的肾脏-膀胱代谢速率和更低的尿道膀胱放射性积累。高浓度的膀胱放射性伪影,不仅会造成PET图像中的halo伪影,也在视觉层面直接影响对前列腺癌原发病灶及淋巴结转移的观察和评估。在一项针对712名患者的18F-flotufolastat独立影像评估中,三位评阅人被要求对18F-flotufolastat的PET图像中尿道和膀胱中的放射性积及其对前列腺癌病灶诊断的影响进行三分制评分,其中0分代表尿道基本无摄取,膀胱活度较低;1分代表尿道呈现轻度摄取,但膀胱和尿道中的摄取不影响对前列腺癌病灶的观测;2分代表尿液活性阻碍前列腺癌病灶评估,如下图3所示。经独立评估,3名阅片人鉴定616-694名患者图像中,尿道和膀胱放射性积累对前列腺癌的观察无明显影响,评阅人可以明显区分高活性尿区和病灶[8]。
此外,值得一提的是,flotufolastat通过元素交换标记后,由于标记前体和分子探针具有完全相同的结构,18F-flotufolastat无需也无法通过高效液相色谱与flotufolastat分离,这无疑大大减轻了18F-flotufolastat的制备难度和工艺技术要求,缩短了18F-flotufolastat的制备时间,有利于科室的自制自用和推广普及,且不经历HPLC分离的18F-flotufolastat仍可保持高比活度,实现对PSMA的靶向PET显像。
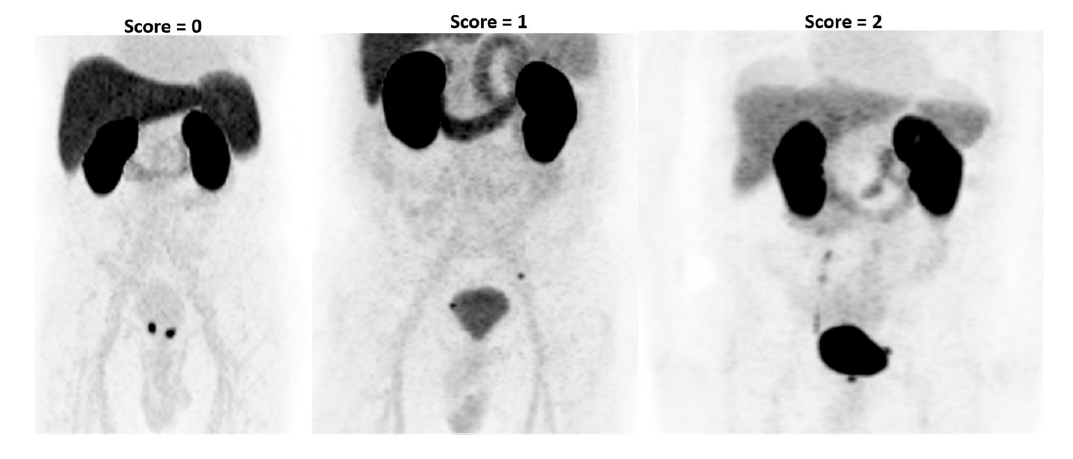
图4 18F-flotufolastat在尿道、膀胱中的积累对前列腺癌病灶观测影响的三分制评价[8]
笔者认为基于flotufolastat有望实现真正意义上的PSMA靶向核素诊疗一体化,如natF-177Lu-flotufolastat +18F-natLu-flotufolastat的配合使用,二者具有完全相同的分子结构,基于18F-natLu-flotufolastat的PET-CT成像,可以实现对natF-177Lu-flotufolastat精准的治疗方案规划、治疗响应预测、治疗效果评估等。目前,flotufolastat在美国和欧洲已完成“用于生化复发前列腺癌的PET-CT诊断性能的评估与安全性研究”的多中心三期临床实验(详见下期分享)[9],部分PET结果如下图5所示,国内已有药企开始布局flotufolastat的三期临床实验,希望flotufolastat能够顺利完成临床实验,早日造福前列腺癌患者。
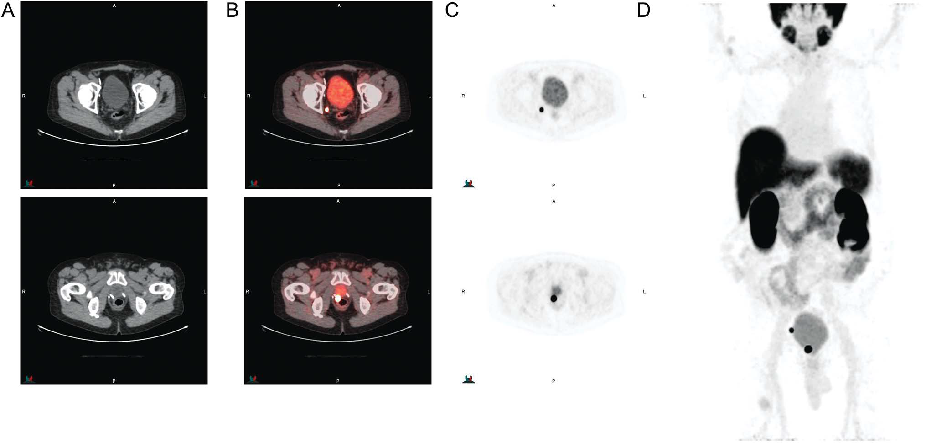
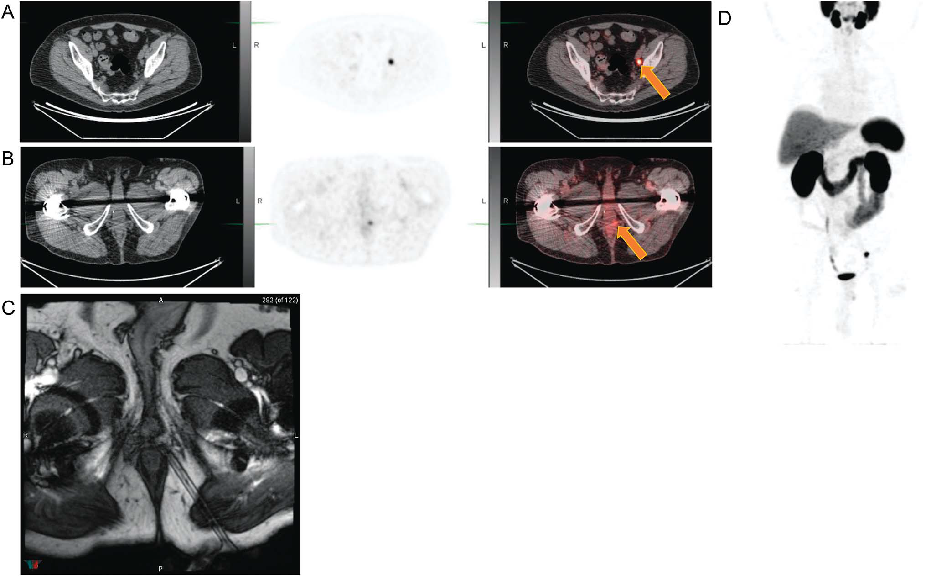
图5 18F-flotufolastat三期临床试验中的典型PET图像[9]
独立影像评估(IRC)在核药领域临床研究中的多维度应用
1.对于核药的安全性临影医药能做什么?
提供药代分布及吸收剂量计算,包括:器官、病灶勾画(自动及半自动),药代分布和吸收剂量的计算与报告。
2. 能否协助完成检查设备的验证校准和模体试验?
可以完成。特别是一些的多中心临床试验(例如帕金森病和阿尔兹海默症核药诊断类药物等),需要考虑不同检查设备之间的显像差异,临影医药提供PET设备检测模体及设备活度校准,出具模体分析报告及对应的不同扫描Protocol的校正表。

Hoffman 3D 脑模体
3. 如何对使用放射性核素(核药)进行诊断或者治疗的患者进行影像学评估?
在核医学领域,临影医药拥有经验丰富的核药影像评估专家资源,基于疗效评价标准,最终给出客观和准确的评估结果。
在核药的临床试验中,影像评估可能受到多种因素的影响,如评估者的主观判断、图像采集的质量和设备操作差异等。临影医药作为第三方独立影像评估机构,可以制定规范的影像采集标准,确保其评估结果更加客观和一致,有助于减少评估过程中的偏倚和可变性。
参考文献:
[1] R. J. Rebello, C. Oing, K. E. Knudsen, S. Loeb, D. C. Johnson, R. E. Reiter, S. Gillessen, T. Van der Kwast, R. G. Bristow. Prostate Cancer. Nat. Rev. Dis. Primers, 2021, 7, 9-35.
[2] P. Mhawech-Fauceglia, S. Zhang, L. Terracciano, G. Sauter, A. Chadhuri, F. R. Herrmann, R. Penetrante. Prostate-Specific Membrane Antigen (PSMA) Protein Expression in Normal and Neoplastic Tissues and its Sensitivity and Specificity in Prostate Adenocarcinoma: an Immunohistochemical Study Using Mutiple Tumour Tissue Microarray Technique. Histopathology 2007, 50, 472– 483.
[3] F. Rosar, M. Bartholom, S. Maus, B. M. Privé, F. Khreish, G. M. Franssen, Y. H. W. Derks, J. Nagarajah, S. Ezziddin. 89Zr-PSMA-617 PET/CT May Reveal Local Recurrence of Prostate Cancer Unidentified by 68Ga-PSMA-11 PET/CT. Clin. Nucl. Med., 2022, 47(5):435-436.
[4] 邹思娟,宋双,陈利星,周见远,成钊汀,朱小华. 68Ga-PSMA-617 PET/CT与MRI对中高危前列腺癌诊断和分期的对比[J]. 中华核医学与分子影像杂志, 2020, 40:710-715.
[5] R. Hermsen, E. B. C. Wedick, M. J. M. Vinken, L. W. M. V. Kalmthout, J. P. A. V. Basten. Lymph node staging with 18F-PSMA-1007 PET/CT in newly diagnosed prostate cancer using histopathological evaluation as a reference. Eur. Urol., 2021, 79:1169-1170.
[6] A. Heinzel, D. Boghos, F. M. Mottaghy, F. Gaertner, M. Essler. Ga-68-PSMA PET/CT for monitoring response to Lu-177-PSMA-617 radioligand therapy in patients with metastatic castration-resistant prostate cancer. Eur. J. Nucl. Med. Mol. I., 2019, 5:1054-1062
[7] A. Wurzer, D. Di Carlo, A. Schmidt, R. Beck, M. Eiber, M. Schwaiger, H. J. Wester. Radiohybrid Ligands: A Novel Tracer Concept Exemplified by 18F- or 68Ga-Labeled rhPSMA Inhibitors. J. Nucl. Med., 2020, 61:735-742.
[8] P. H. Kuo, R. Hermsen, R. Penny, E. J. Postema. Quantitative and Qualitative Assessment of Urinary Activity of 18F-Flotufolastat-PET/CT in Patients with Prostate Cancer: a Post Hoc Analysis of the LIGHTHOUSE and SPOTLIGHT Studies. Mol. Imaging Biol., 2024, 26:53-60.
[9] A. B. Jani AB, G. C. Ravizzini, B. A. Gartrell, B. A. Siegel, P. Twardowski, D. Saltzstein, M. T. Fleming, A. Chau, P. Davis, B. F. Chapin, D. M. Schuster; SPOTLIGHT Study Group. Diagnostic Performance and Safety of 18F-rhPSMA-7.3 Positron Emission Tomography in Men With Suspected Prostate Cancer Recurrence: Results From a Phase 3, Prospective, Multicenter Study (SPOTLIGHT). J Urol. 2023, 210:299-311.