



 有临
有临
 2024.08.08
2024.08.08
 1448
1448
123
01.α核素治疗与211At-NaAt简介
在核素治疗如火如荼、核药赛道百舸争流的今天,α放射性核素药物在科研和临床中仍然极为罕见。相较于β-衰变核素,α衰变核素具有更高的线性能量转移和细胞损伤、更短的穿透距离和DNA双线损伤、更低的氧依赖性和旁观者效应、更安全的操作和防护、门诊诊疗而无需住院的可能性等优异性能,但是受限于核素生产、药物构造和复杂的体内动力学(如α核素衰变具有更大的反冲动量,药物稳定性更低;核素衰变链长,母核衰变产生的子核仍具有放射性,但子核药物结构控制困难,且二者的药代动力学存在差异又难以区分等),α衰变放射性药物的开发相较于β-核素研究进展缓慢。
211At作为一类非金属放射核素,通过He核轰击209Bi制备,即209Bi(4He, 2n)211At反应制备,如下图1所示,是目前研究最多的用于放射性药物发开的α核素之一。211At经α衰变为207Bi(41.8%),电子捕获衰变为211Po(58.2%),物理半衰期为7.214 h。211Po的子核素通过α射线衰变为稳定的207Pb,半衰期为0.516 s,因此可认为211At为100% α衰变核素。211At-NaAt,由Tadashi Watabe教授等人率先提出,适用于131I-NaI常规治疗无效或无法继续治疗的分化性甲状腺癌。At作为I的同组卤素,同样可借由钠碘转运体(NIS)富集于甲状腺部位,实现对甲状腺肿瘤的内照射治疗。211At的药代动力学行为也与碘相似,通过钠-碘转运体分布于胃、甲状腺、唾液腺等,并经尿液排出。

图1 He核轰击后的Bi靶,211At沉积其中
02.211At-NaAt的生产
211At通过209Bi(4He, 2n)211At反应制备后,通过干馏纯化得到纯净的211At。将211At洗脱入水溶液(1%抗坏血酸钠+2.3%碳酸氢钠)中后,封闭体系搅拌1小时后,过0.22 μm无菌滤膜,即可得到制剂化的211At-NaAt,入下图2所示。

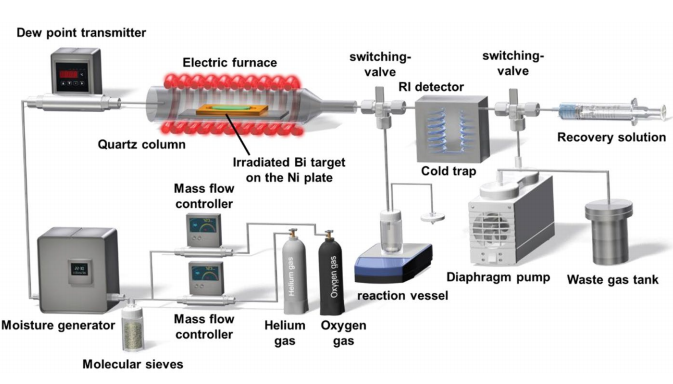
图2 211At-NaAt的自动化生产模块(左)和生产线路
03.211At-NaAt治疗规范手册
1. 治疗配套人员参与:医生、负责辐射安全管理的放射学技师(物理师)、负责患者协助核管理的护士及其他安全负责人员。执行治疗的医疗机构的管理人员必须指派一名放射安全管理监督员(Supervisor, S),S应当对治疗进行监督,并指派至少一名放射安全管理人员(Manage,M),M负责确保治疗过程中的辐射安全规范,并在S的监督下负责对患者及其家属的培训和教育;
2. 患者释放条件,当患者满足一下任意一条时,可释放患者:给药积累或者残余活度不超过相应活度,患者距离1米处的体外剂量不超过临界值, 根据每个患者的具体情况进行累积剂量计算,满足条件的可以释放。(相关内容具体参考: Release of patients who have been administered a radiopharmaceutical (Notifcation No. 0511–1 by the Director of Medical Care Planning Division, Health Policy Bureau, Ministry of Health, Labour and Welfare, dated May 11, 2016)。患者释放需及时记录并保存2年;
3. 患者管理:患者需有独立判断和行动能力,可门诊治疗,无需住院,患者释放后需向患者及其家属提供有关辐射保护的教育和培训,确保患者家中具备适当的污水和厕所设施;患者需尽量减少与儿童和孕妇的接触;
4. 药物的接收、使用、存储和处理过程应通过日志记录,记录内容包括产品标准、到达日期、使用时间、使用体积、残余体积、使用者、患者信息、储存和处理时间、储存和处理药品的放射性活度等;
5. 211At活度测试:211At测试与其他核素无异,由于211At是一种迄今为止尚未使用过的核素,井式电离室可能无法对其进行校准(没有211At的校准常数或刻度盘设置)。第一次测量时,必须事先对测量装置进行校准,否则,必须联系制造商设置校准常数或刻度盘设置。
6. 操作防护:211At的防护以内照射防护为主,外照射防护为辅,药物、操作器械设备、患者及患者的代谢物均是需做防护的放射源;防护装备主要包括:防护眼睛、防护手套、吸水聚乙烯滤纸、镊子和污物桶等。
7. 患者给药:患者单次给药最大剂量为1 GBq。
8. 医护内照射剂量计算:医护剂量 E = e × I,其中e为有效剂量系数,针对211At, e = 2.7 × 10−5,I为每周吸入的放射性核素的活度(Bq); I 计算方式 I = 1.2×106 × C × t,其中1.2×106为成年人每小时吸入空气体积,t为每周工作小时数,C为每周空气中的平均放射性浓度为[Bq/cm3]。其中C的计算方式 C = A ×散射率×每周源使用天数/[V × 106 × 8 [h] ×排气设备每周运行天数],其中A为最大日实验活度[Bq],V[m3/h]为换气设备单位小时换气体积。
如,A: 1.0 [GBq];scattering rate: 0.001;每日换气体积 560 [m3/h]×8 [h];每周使用源1天;换气设备每周工作5天;每周工作时间10 min。则剂量E计算如下所示:
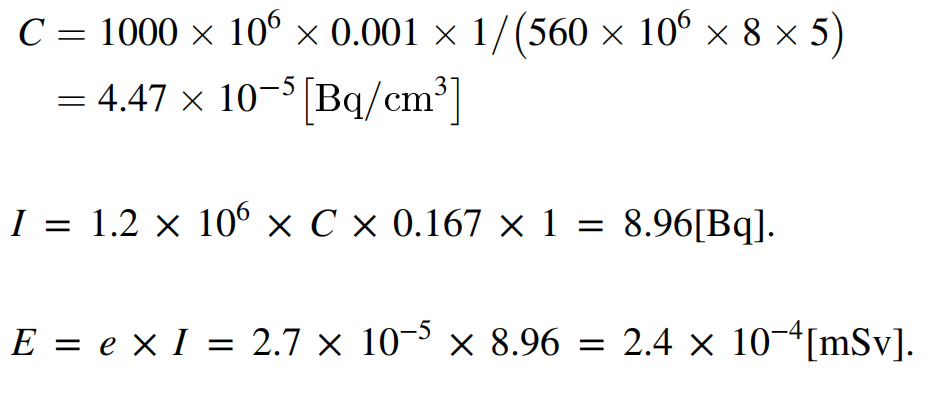
9. 外照射剂量计算:211At-NaAt给药后,患者作为放射源,对包括医护人员和家属存在外照射,其累计剂量计算方式为:外照射剂量I = A × C × Fa / L2。其中A为患者体内药物活度,C为有效剂量率常数,一般对于211At取值 0.00644,L[m]为和患者距离,Fa为有效剂量透过率,Fa随着和患者之间物质格挡和阻碍叠加。而后累计剂量计算方式为:
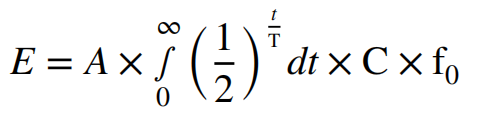
其中A为患者体内药物活度,C为有效剂量率常数,一般对于211At取值 0.00644,L[m]为和患者距离,F0为暴露系数,患者照顾者一般取0.5,非照顾者取0.25。
04.动物实验
在一项K1-NIS荷瘤鼠131I-NaI和211At-NaAt的疗效评估研究中,研究者通过体外(DNA双链损伤、细胞克隆抑制)和体内(体内生物分布、不同剂量下肿瘤生长曲线,211At-NaAt 0.4 MBq,0.8 MBq,1.2 MBq vs. 131I-NaI 1 MBq,3 MBq,8 MBq)两方面评估,确定了211At-NaAt在分化性甲状腺癌治疗中的优势。体外研究表明,211At-NaAt相较于131I-NaI可以产生更严重的DNA双链损伤,且十分之一活度下的211At-NaAt相较于131I-NaI具有更高的肿瘤细胞克隆抑制效果,如下图3所示。
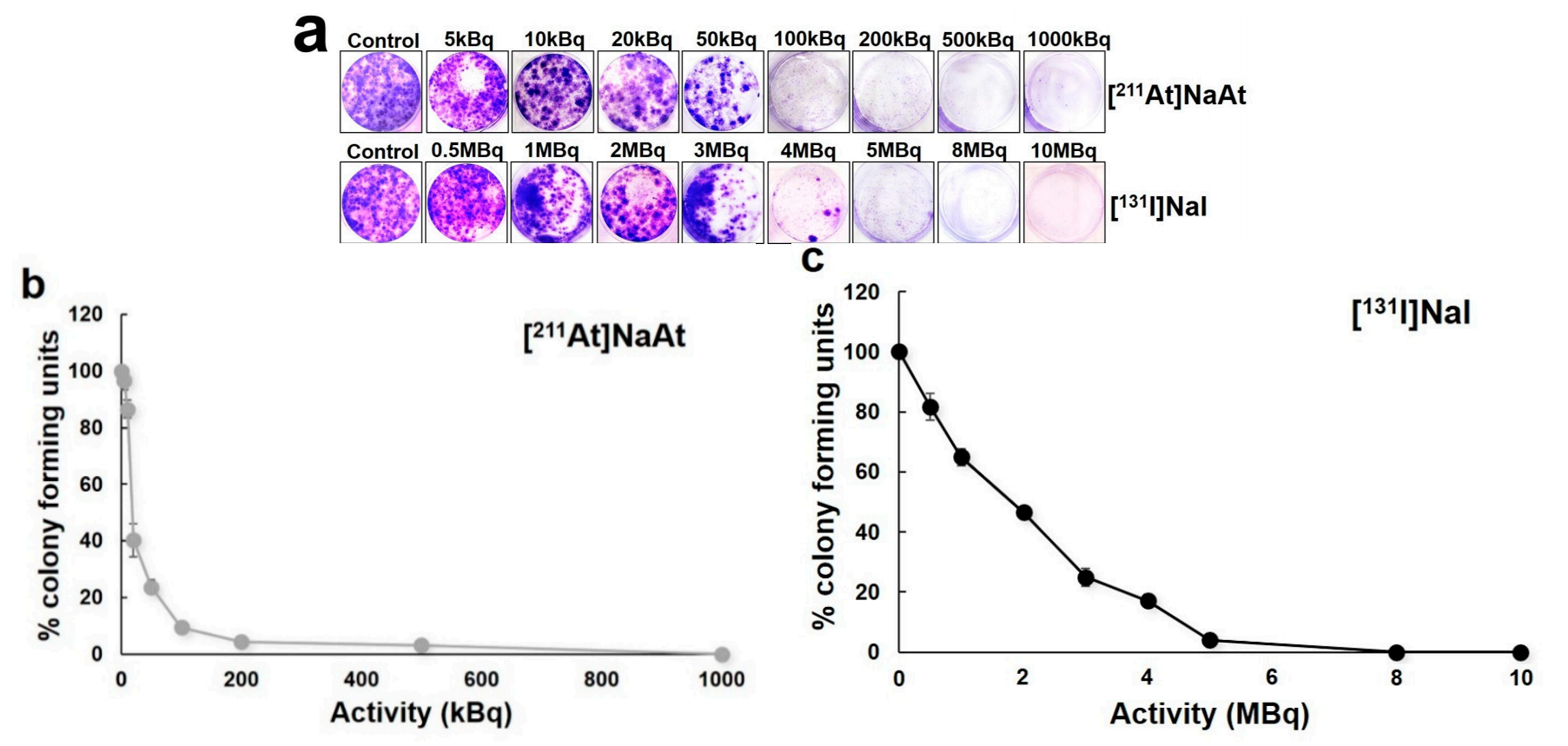
图3 211At-NaAt和131I-NaI的DNA双链抑制效果对比(a)基不同活度下的肿瘤细胞克隆抑制率(b,c)
对于体外研究,在甲状腺中,131I-NaI的摄取显著高于211At-NaAt;但在其他器官和肿瘤中,211At-NaAt的摄取显著高于131I-NaI,如下图4所示。两者均表现出剂量依赖性的肿瘤生长抑制作用。但211At-NaAt显示出更强的肿瘤生长抑制效果,肿瘤在给药后较长时间内(18、25、46天,对应不同剂量)未发生生长。相比之下,131I-NaI在给药后较短时间内(1 MBq给药后12天内,3 MBq给药后19天内对应不同剂量,8 MBq给药肿瘤不发生再生长)可观察到肿瘤再生长,如下图5所示。
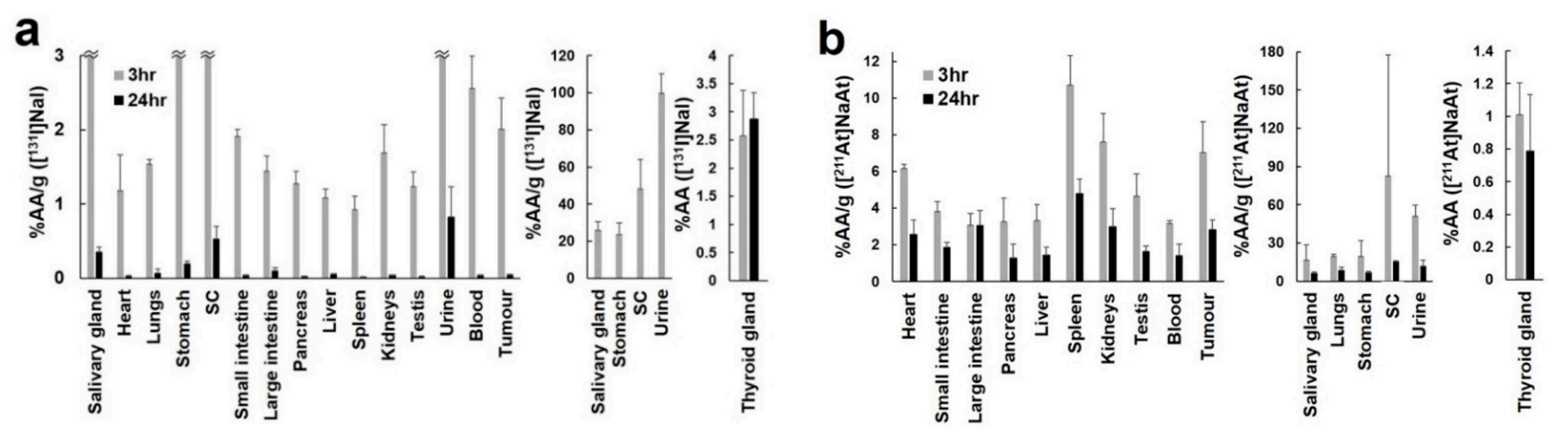
图4 131I-NaI(a)和211At-NaAt(b)的体内生物学分布
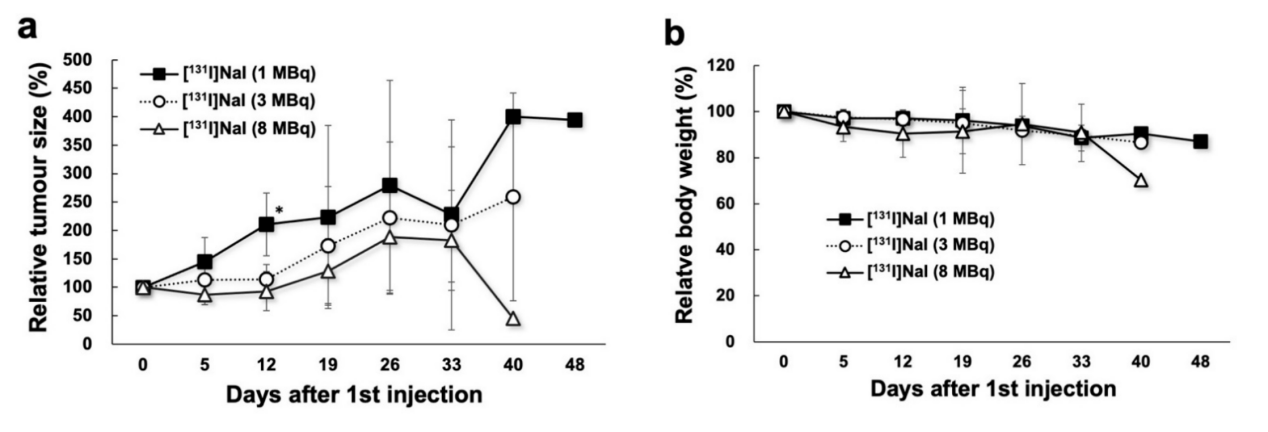
图5 131I-NaI(a)和211At-NaAt(b)给药后肿瘤再生长情况
05.展望
针对分化型甲状腺癌,211At-NaAt相较于131I-NaI具有更强的治疗效果。2021年11月,日本Tadashi Watabe教授已在大阪大学医院发起并开展211At-NaAt的临床试验,希望211At-NaAt可以尽快进入临床,造福甲状腺癌患者。
芦鑫淼 撰写 秦维伟 审核