



 有临
有临
 2024.07.10
2024.07.10
 925
925
mRNA技术将编码特定抗原的外源mRNA递送至体内,在细胞质中直接进行翻译,特异性表达相应蛋白,诱导细胞和体液双重免疫。其通用、快速、灵活的特点应用于不同领域的疫苗/药物开发。mRNA疫苗在抗击新冠疫情上取得的成效验证了mRNA技术的可行性,其优势和潜力有望对生物制品发展产生深远影响。
分类
l 非复制型:编码抗原蛋白的目的基因及必要的用于稳定mRNA和促进转录的功能性元件,在人体内无法自我复制;通常结构简单,不存在额外的编码蛋白。这些特点有利于进行临床前研究,并已有成功案例用于COVID⁃19预防接种。但还需要进一步延长并提高体内mRNA表达周期和水平。
l 自扩增型:大多数是基于甲病毒基因组,编码抗原的mRNA代替甲病毒结构蛋白RNA,进入体内后自我复制产生编码抗原蛋白的mRNA。其病毒复制机制,可最小化mRNA所需剂量;同时由于具有较高抗原表达水平,可诱导更强大的免疫应答。
l 环状:与线性mRNA相比,环状mRNA由于其共价闭环结构而高度稳定,可保护其免受核酸外切酶介导的降解。但体外转录产生的环状mRNA的潜在免疫原性引人担忧,仍需进一步测试是否可以开发成安全有效的技术平台。
特点
l 抗原选择范围广,理论上经过适当修饰或改造的mRNA可编码任何一种蛋白。
l 外源mRNA可激活模式识别受体(PRR),刺激非特异性免疫反应,进而激发T、B细胞免疫反应,具有“自我佐剂”的特点,表现更强的免疫原性。
l 与质粒DNA疫苗相比不进入细胞核内部,只在细胞质内表达抗原,不存在整合人体基因上的风险。
l 不依赖细胞培养技术,可快速构建及生产,外源因子传播风险较低。
l 递送载体如脂质纳米颗粒(LNP)除稳定和保护mRNA外,也具有一定的免疫原性,可增强疫苗的免疫反应。
技术难点
l mRNA递送系统的效率、生产、纯化、系统管理和冷冻储存供应链领域。
l 递送系统:mRNA疫苗需要通过细胞外的“胞外屏障”和细胞内的“内体逃逸”及“胞内免疫”多重考验后到达细胞内靶部位。其体内稳定性较低,易被血清中RNA水解酶降解,或被单核-巨噬细胞系统吞噬而无法到达靶细胞发挥作用;免疫应答及自发跨膜效率低,导致研究进展缓慢。
l 纯化:高纯度的mRNA是高效翻译和减少不良免疫反应所必需的,包括酶、核苷酸、质粒模板和异常的RNA在内的多种杂质需要多步纯化才能完成,并且涉及多种正在开发的工艺,例如可以使用沉淀、亲和oligo dT、含或不含纤维素的离子对色谱(IPC)、离子交换色谱和切向流过滤(TFF)等技术。因此,替代纯化配体和更加精细的纯化方法将极大地有益于下游行业的发展。
l 成本:尽管mRNA疫苗基于无细胞生产体系,理论上有可能比其他疫苗方法成本更低,但实际上目前生产成本可能更高。为了改善整体的成本状况,需要降低GMP试剂、加帽试剂和专利等的成本。
l 专利壁垒:尽管中国整体mRNA专利位居世界第二,但目前比较关键、具有产业化前景的mRNA技术主要集中在欧美企业。
l 运输:目前mRNA疫苗的储运条件较为苛刻,如已上市的2个mRNA疫苗的储运条件分别为- 70℃(BNT162b2)和- 20℃(mRNA -1273),且因mRNA稳定性较差,易被核酸酶降解,对接种环境的要求亦相对较高。
有效性:
l 研究表明,有的mRNA疫苗,人体中的中和抗体滴度低于动物模型,有效性与动物模型差异较大。
l 裸mRNA无法被有效递呈至细胞内并成功从溶酶体逃逸,体内体液和细胞免疫较低,因此需要脂质体增强细胞摄取并改善向细胞质转译机制的传递,从而提高mRNA疫苗的作用。
安全性:
l 研究表明,有的mRNA疫苗,人体中的中和抗体滴度低于动物模型,有效性与动物模型差异较大。
l 裸mRNA无法被有效递呈至细胞内并成功从溶酶体逃逸,体内体液和细胞免疫较低,因此需要脂质体增强细胞摄取并改善向细胞质转译机制的传递,从而提高mRNA疫苗的作用。
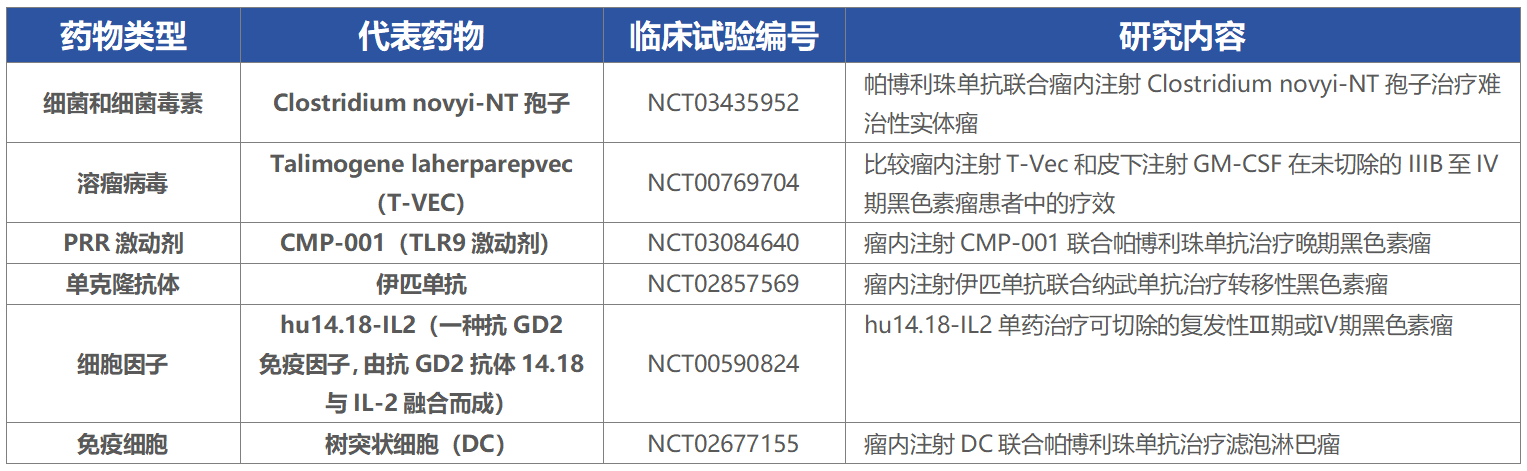
表1 部分瘤内免疫治疗药物[2]
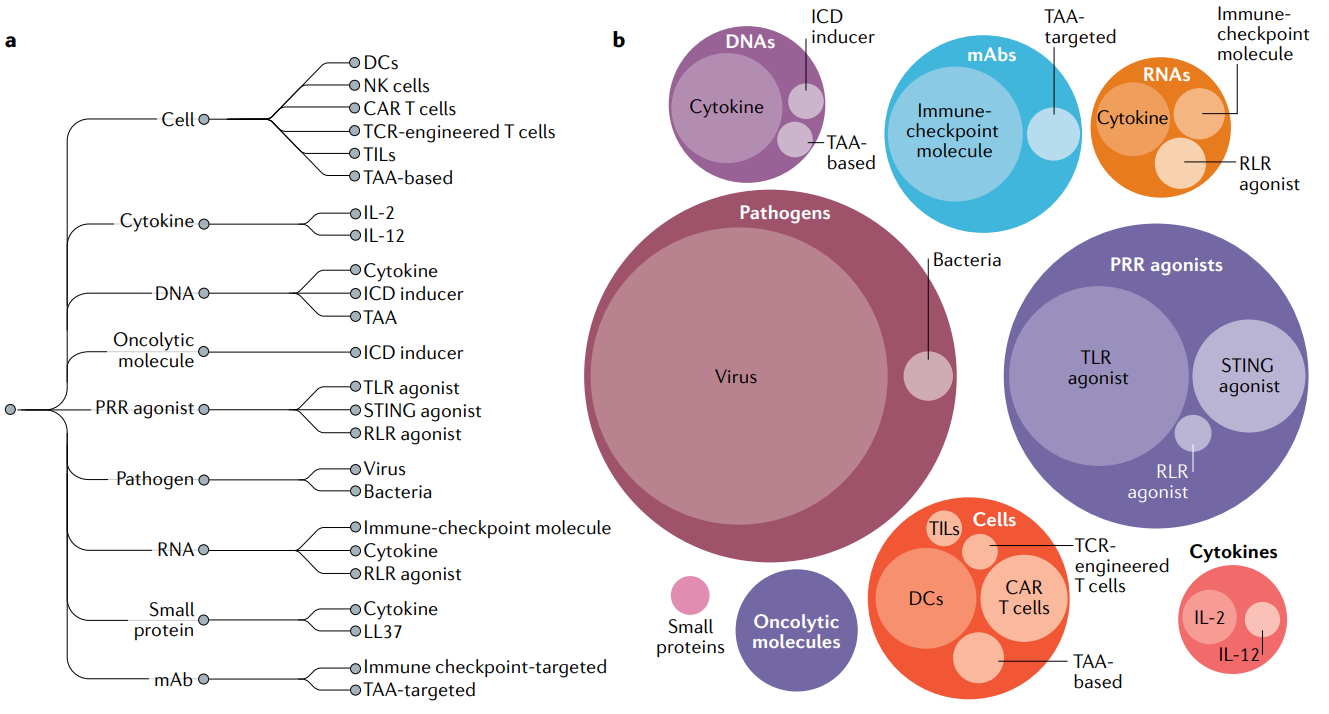
图1 瘤内免疫治疗的临床试验现状[3]
挑战一:维持局部给药浓度
目前的免疫治疗药物大多为水溶液,注射后扩散较快,较难维持其在肿瘤局部的有效治疗浓度。反复进行瘤内注射是一种可行的策略,可以减少全身毒性的风险并获得更高的局部生物活性药物浓度,但会增加并发症的发生,同时增加患者不适,影响用药依从性。因此,优化药物输送方式,使药物能够在病灶区域内富集、显著延长药物在病灶局部的滞留时间和提高肿瘤细胞对药物的摄取率,以减少给药次数和给药剂量是当下迫切的需求。
对于瘤内注射的药物,目前可采用如细胞膜仿生纳米、凝胶等形式负载瘤内注射药物。采用细胞膜伪装纳米粒子是一种新型的递药策略,这类仿生纳米颗粒继承了源细胞(例如红细胞、免疫细胞、肿瘤细胞和血小板)的特定生物学活性,可直接利用活细胞对药物进行负载,也可以提取细胞膜将其制备成生物囊泡,或包裹于纳米颗粒的表面。这类载体因为源于人体细胞,与生物体融合性强,将其作为药物或基因治疗药物的载体制成仿生递送系统,其能到达指定位置,再特异性地释放药物,从而减少药物给人体带来的不良反应,如用于肝细胞癌的双靶点免疫基因治疗多功能仿生纳米载体siRNA-CaP@PD1-NVs[4]。
挑战二:完善疗效评估标准
瘤内免疫治疗的注射给药方式,决定了其必然会对病灶区域造成一定损伤,进而对治疗疗效的评估产生一定干扰。对于晚期实体瘤患者,瘤内免疫治疗会带来“注射病灶”和“非注射病灶”疗效的区别,这也是既往免疫治疗疗效评价中未曾遇到的问题。考虑到瘤内免疫治疗的独特性,其疗效评价的难点不仅在于排除伪进展,还在于如何在实体瘤的瘤内免疫治疗过程中提供灵活指导。因此,现有的免疫治疗疗效评估标准(iRECIST)并不适用于客观评价瘤内免疫治疗的疗效。
2020年,在实体瘤反应评估标准1.1版(RECIST 1.1)和实体瘤免疫治疗评估指南(iRECIST)的基础上,达成了关于实体瘤的瘤内免疫治疗疗效评价标准(itRECIST)的共识,将病变部位的测量、病灶的分类选择、注射的先后顺序以及治疗期间的疗效评估方式和周期等都纳入了考察范围,并据此作出了一系列初步规定。但目前该疗效评价体系未在相关临床研究中得到推广。
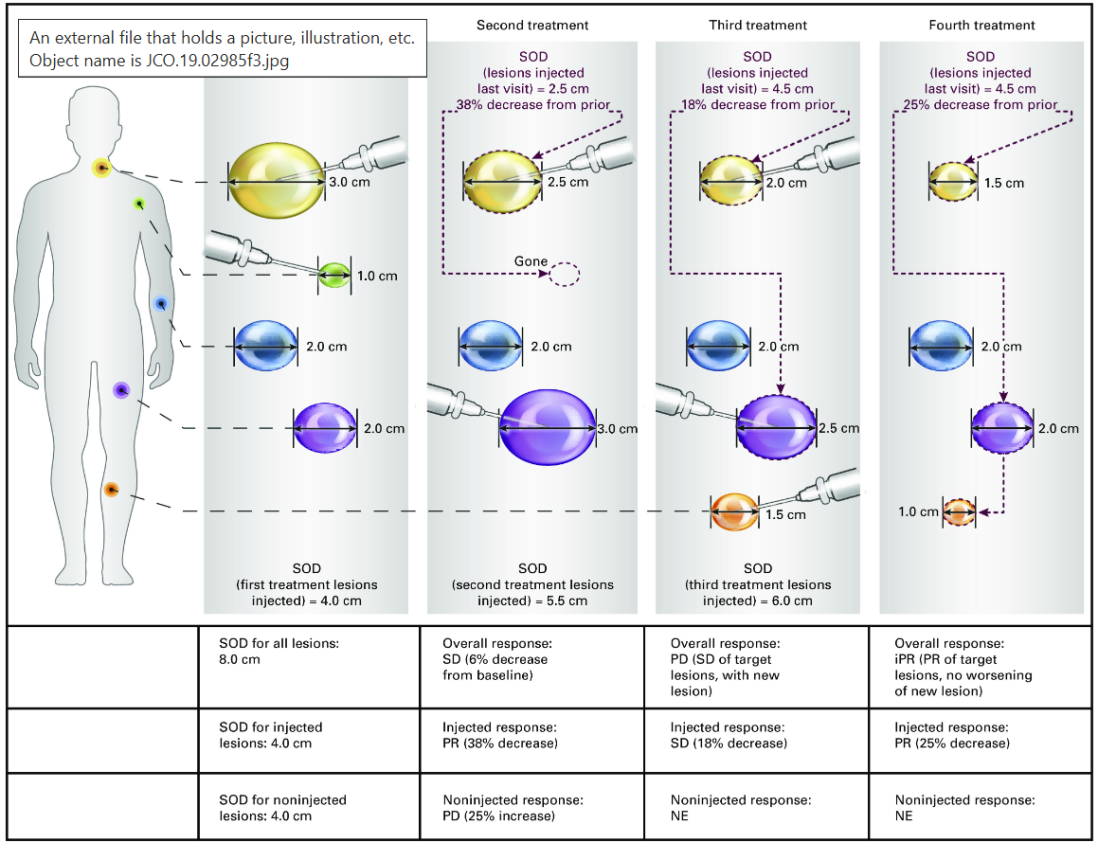
图 2 itRECIST--治疗期间注射病变反应的迭代评估示例[5]
挑战三:监管法规
瘤内免疫疗法作为一种新兴抗肿瘤治疗手段,因科学研究尚不完善、获批药物较少、参考法规有限,其临床开发及上市路径目前难以按图索骥,这些问题都给药物的审评上市带来了不少挑战。
以溶瘤病毒为例,大多数溶瘤病毒采用瘤内注射的方式,许多建立临床试验终点、药代动力学、剂量和方案的传统方法不适用于溶瘤病毒的评估。在缺乏临床前数据的情况下,大部分临床开发都是经验性的。随着溶瘤病毒产品逐渐走入临床研发阶段,监管部门也不断出台相应法规指南以应对这一挑战。国家药品监督管理局药品审评中心2021年颁布的《溶瘤病毒类药物临床试验设计指导原则(试行)》指出[6]“溶瘤病毒的主要作用机制中包括对目标病灶的直接溶瘤效果和对未给药的远隔病灶的旁观者效应(又称远端效应),因此溶瘤病毒即使采用瘤内给药,其疗效评价,包括靶病灶选择、测量等应能全面的反映抗肿瘤效果,全身疗效评估仍是溶瘤病毒有效性的主要证据之一”。同年发布的《免疫细胞治疗产品临床试验技术指导原则(试行)》[7]对于瘤内给药方式的免疫细胞治疗提出“当研究者和操作人员的临床经验和技能可能影响产品的安全性和有效性时,要求申请人应对研究者和操作人员培训、研究或熟练度水平规定最低要求。”对操作人员进行特定给药及治疗程序的培训可能降低给药或治疗过程的变异,必要时可制定详细的书面标准操作规程(SOP)以确保产品给药的安全性和一致性。监管部门一系列指导原则的发布另瘤内免疫治疗的开发之路逐渐有迹可循。
综上,实体瘤的瘤内免疫治疗是一种前沿的治疗模式,通过在肿瘤微环境中直接激活免疫反应,具有减少全身性不良反应、提高局部抗肿瘤效力的优势。这种治疗方法可以与手术、放疗等其他治疗手段结合,形成综合治疗方案。虽然程序、监管和分析方面的挑战需要多学科专家共识和系统研究,但是以实体瘤的瘤内免疫治疗为代表的局部免疫治疗手段必将推动免疫治疗未来格局的演变,是肿瘤免疫治疗领域中一个充满希望的研究方向。
参考文献:
[1]LOCY H, DE MEY S, DE MEY W, et al. Immunomodulation of the tumor microenvironment: turn foe into friend[J/OL]. Front Immunol, 2018, 9: 2909[2022-06-03].
[2]李想,刘宝瑞,李茹恬.新方向、新理念、新挑战:实体瘤内免疫治疗技术的前世今生[J].中国肿瘤生物治疗杂志,2022,29(10):863-870.
[3]Melero I, Castanon E, Alvarez M, Champiat S, Marabelle A. Intratumoural administration and tumour tissue targeting of cancer immunotherapies. Nat Rev Clin Oncol. 2021 Sep;18(9):558-576.
[4]Sun Y, Liu Y, Li R, Zhang C, Wu M, Zhang X, Zheng A, Liao N, Zheng Y, Xu H, Zeng R, Zeng Y, Liu X. Multifunctional Biomimetic Nanocarriers for Dual-Targeted Immuno-Gene Therapy Against Hepatocellular Carcinoma. Adv Sci (Weinh). 2024 Jul 8:e2400951.
[5]Goldmacher GV, Khilnani AD, Andtbacka RHI, Luke JJ, Hodi FS, Marabelle A, Harrington K, Perrone A, Tse A, Madoff DC, Schwartz LH. Response Criteria for Intratumoral Immunotherapy in Solid Tumors: itRECIST. J Clin Oncol. 2020 Aug 10;38(23):2667-2676.
[6]《溶瘤病毒类药物临床试验设计指导原则(试行)》2021.
[7]《免疫细胞治疗产品临床试验技术指导原则(试行)》2021.
李婧 撰写