



 有临
有临
 2024.11.22
2024.11.22
 1009
1009

肝细胞癌(HCC)占原发性肝癌的75-85%,是全球第六大确诊癌症。对于早期HCC,需要进行根治性消融、切除或肝移植。然而,超过50%的患者初诊时即为晚期疾病,可能需要接受全身治疗。治疗晚期HCC的选择很少,酪氨酸激酶抑制剂索拉非尼和乐伐替尼作为一线全身治疗只能提供有限的改善(将中位生存期延长2-3个月)。最近,阿替利珠单抗-贝伐珠单抗(atezo-bev)的联合治疗已经证明比索拉非尼有显著的生存益处,后者目前是晚期HCC首选的一线全身治疗方法。
放射学反应获取的客观缓解率(ORR)和无进展生存期(PFS)作为治疗疗效的关键指标以及总生存期(OS)的替代指标,需要考虑到停药后改用后线药物或继续使用当前药物对放射学疗效反应评估导致的较大影响,准确的疗效评估是患者管理中重要的环节。
虽然实体瘤反应评价标准1.1(RECIST 1.1)被广泛使用,但往往忽略了治疗后的肿瘤坏死。这促使采用改良的RECIST(mRECIST)和Choi标准作为肿瘤存活的概念。目前很多研究使用RECIST 1.1或mRECIST评估了抗pd -1抗体药物与抗血管生成疗法的放射学反应,但缺乏使用不同的放射反应标准对atezo-bev治疗的反应率及其与生存结果的关系进行评估对比。
近日,首尔圣玛丽医院的Dong Hwan Kim等人发表在European Radiology期刊上的研究对比了分别根据RECIST 1.1、mRECIST和Choi标准评估的ORR和疾病控制率(DCR)的早期缓解率及其与接受atezo-bev治疗的晚期HCC患者PFS和OS的关系。
研究发现在接受atezo-bev治疗的晚期HCC患者中,Choi标准的ORR最高,其次是mRECIST和RECIST 1.1。根据Choi标准确定的早期应答者的OS明显优于无应答者,这表明Choi标准可以被认为是新兴的atezo-bev系统治疗的疗效评估标准。

论文首页截图
该回顾性研究共纳入接受atezo-bev治疗≥3个疗程的晚期HCC患者77例(男性65例;平均年龄62.8±12.3岁)。疗效评估由两名具有5年以上肝脏影像学经验的放射科医生D.H.K.和B.K.根据RECIST 1.1、mRECIST和Choi标准进行盲态独立评估,并互不知晓对方的结果。在基线时确定靶病灶,定义为最长直径≥1cm的肿瘤,优先选取具有代表性的典型肿瘤,如果典型靶病灶数量不足,则考虑非典型肿瘤。短径≥1.5cm的淋巴结也可选做靶病灶,而在mRECIST标准评估中,肝门部淋巴结要求短径≥2cm才可记录为靶病灶。每个器官最多选择2个靶病灶,每个患者最多选择5个靶病灶。非靶病灶记录为是否存在,门静脉癌栓归类为非靶病灶。下图显示了靶病灶评估过程的一个典型案例。
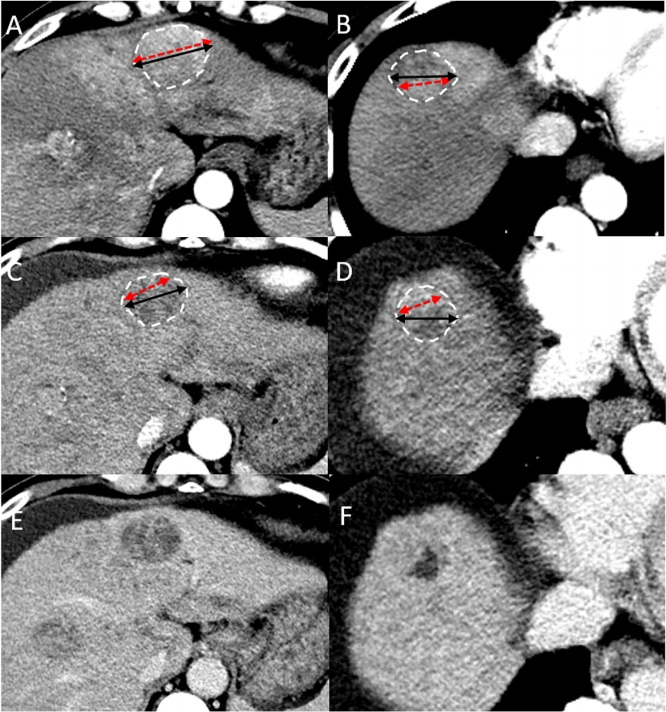
一名64岁男性双叶多结节性HCC,基线(A,B)和第一次随访(C-F)。A,B动脉期图像分别显示2个靶病灶的最长直径之和(7.7cm,黑箭头),以及Choi标准的靶病灶最长直径之和(7.3cm,红箭头),强化区域平均CT值为63.7Hu;C、D动脉期图像显示靶病灶最长直径之和(7cm,黑箭头;5.1cm;红箭头),动脉期强化区域平均CT值为56.1Hu。根据RECIST 1.1标准,疗效为SD,根据mRECIST和Choi标准,疗效达到PR。E、F为门静脉期图像显示肿瘤边缘。
在RECIST 1.1中,测量基线和随访成像时靶病灶的最长直径(SLDs)之和。在mRECIST中,测量肝内靶病灶动脉期增强的活肿瘤的SLDs,对于非典型的肝内和肝外靶病灶,则改为测量整个靶病灶的SLD。在Choi标准中,分析肝内靶病灶的SLDs和平均HU,即在测量靶病灶LD的层面,选择动脉期图像,沿着靶病灶的边界勾画一个感兴趣区测量其平均HU,如果存在多个靶病灶,则需要计算所有靶病灶的平均HU。非靶病灶反应主观上分为完全缓解(complete response,CR)、疾病进展(progressive disease,PD)和非CR非PD,并与靶病灶反应相结合得出总体反应。

RECIST 1.1、mRECIST、Choi标准靶病灶疗效评估定义
该研究主要终点是ORR或应答者的比例(定义为CR或PR),以及DCR,定义为(CR、PR或SD)。次要终点为PFS和OS。
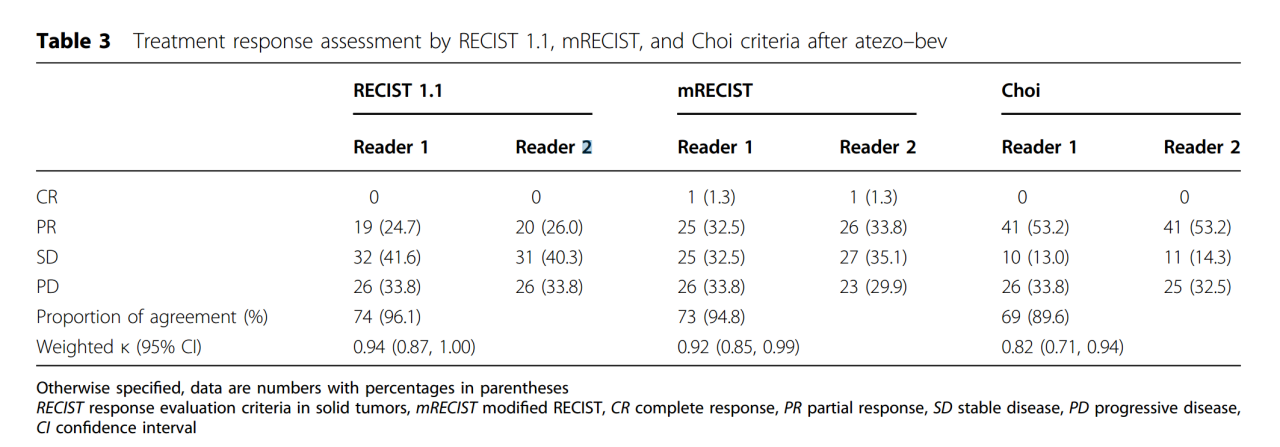
atezo-bev治疗后RECIST 1.1、mRECIST、Choi标准的疗效评估
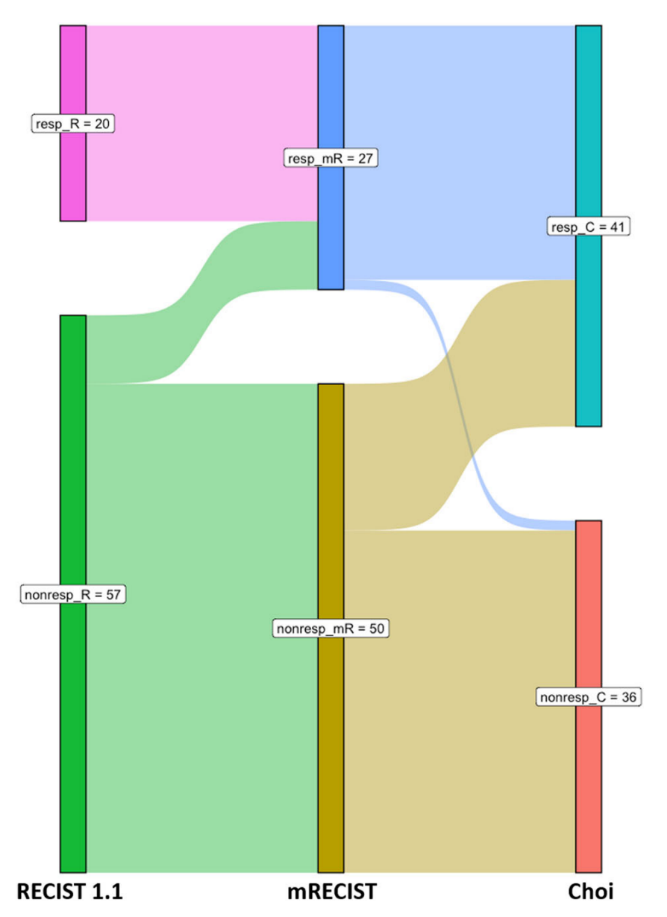
根据RECIST 1.1、mRECIST和Choi标准的治疗反应者和无反应者的Sankey图。
数字表示患者人数。resp:CR或PR的应答者;nonresp:SD或PD的无反应者
77例患者中,有13例(16.9%)患者同时接受了局部放疗。在12例(15.6%)患者中,没有发现典型的肝内靶病灶,因此mRECIST和Choi标准的靶病灶疗效评估依赖靶病灶SLDs的变化。此外,14名患者(18.2%)在基线或反应评估时接受了肝脏多期相MRI,导致无法定量比较肝内靶病灶的动脉增强,因此Choi标准的靶病灶反应是通过SLDs的变化来确定的。
在RECIST 1.1标准下,两名阅片人分别有19(24.7%)和20(26%)例患者达到PR,低于mRECIST标准的25(32.5%)、26(33.8%)以及Choi标准的41(53.2%)、41(53.2%)。在不同的标准和评估者中有数量接近的患者(23-26)评估为PD,导致相似的DCR: RECIST 1.1标准为66.2%,mRECIST标准为64.9-70.1%,Choi标准为66.2-67.5%。阅片人对PD患者的判定非常一致,有很高的一致性。
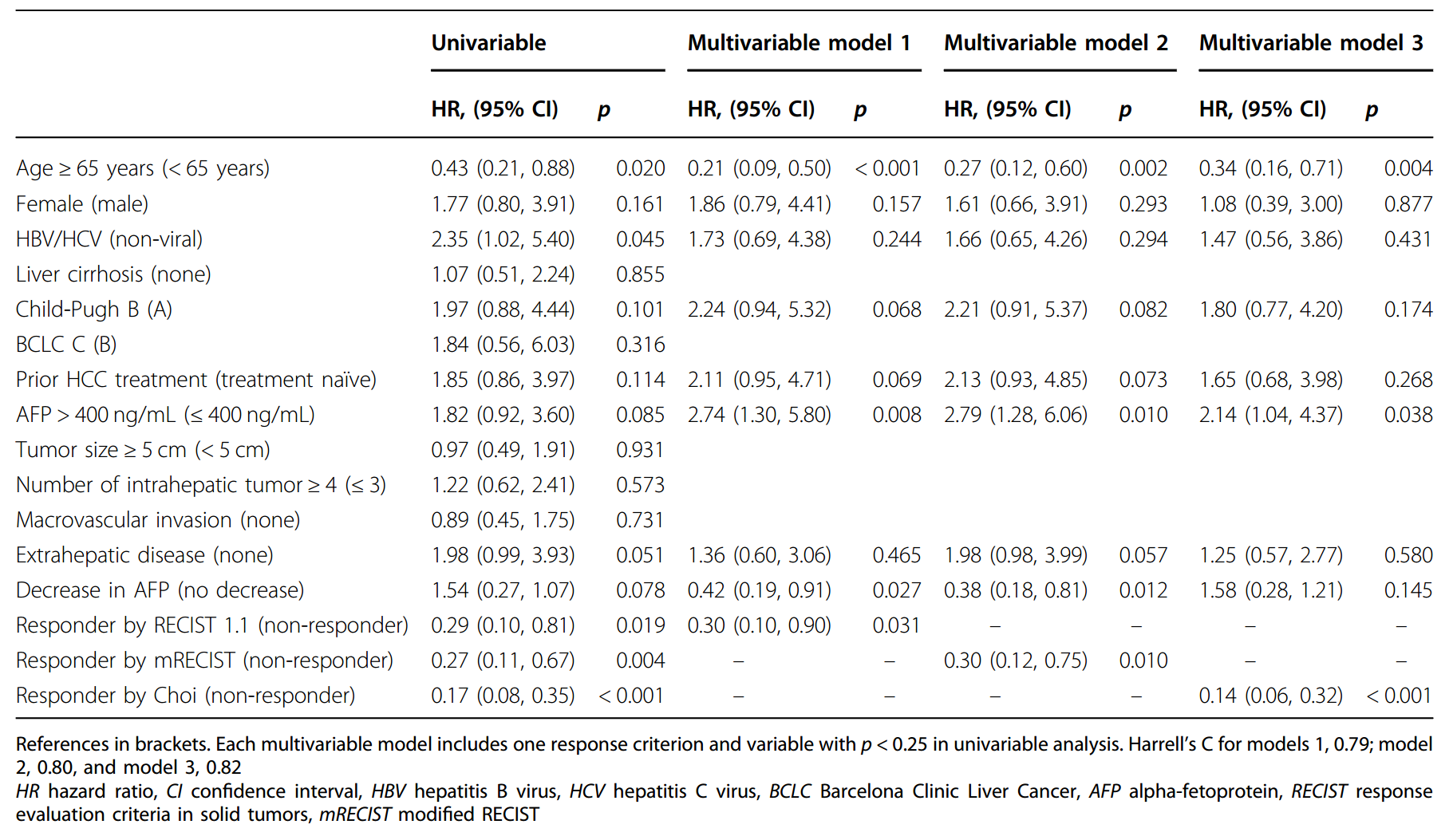
aPFS单变量和多变量分析
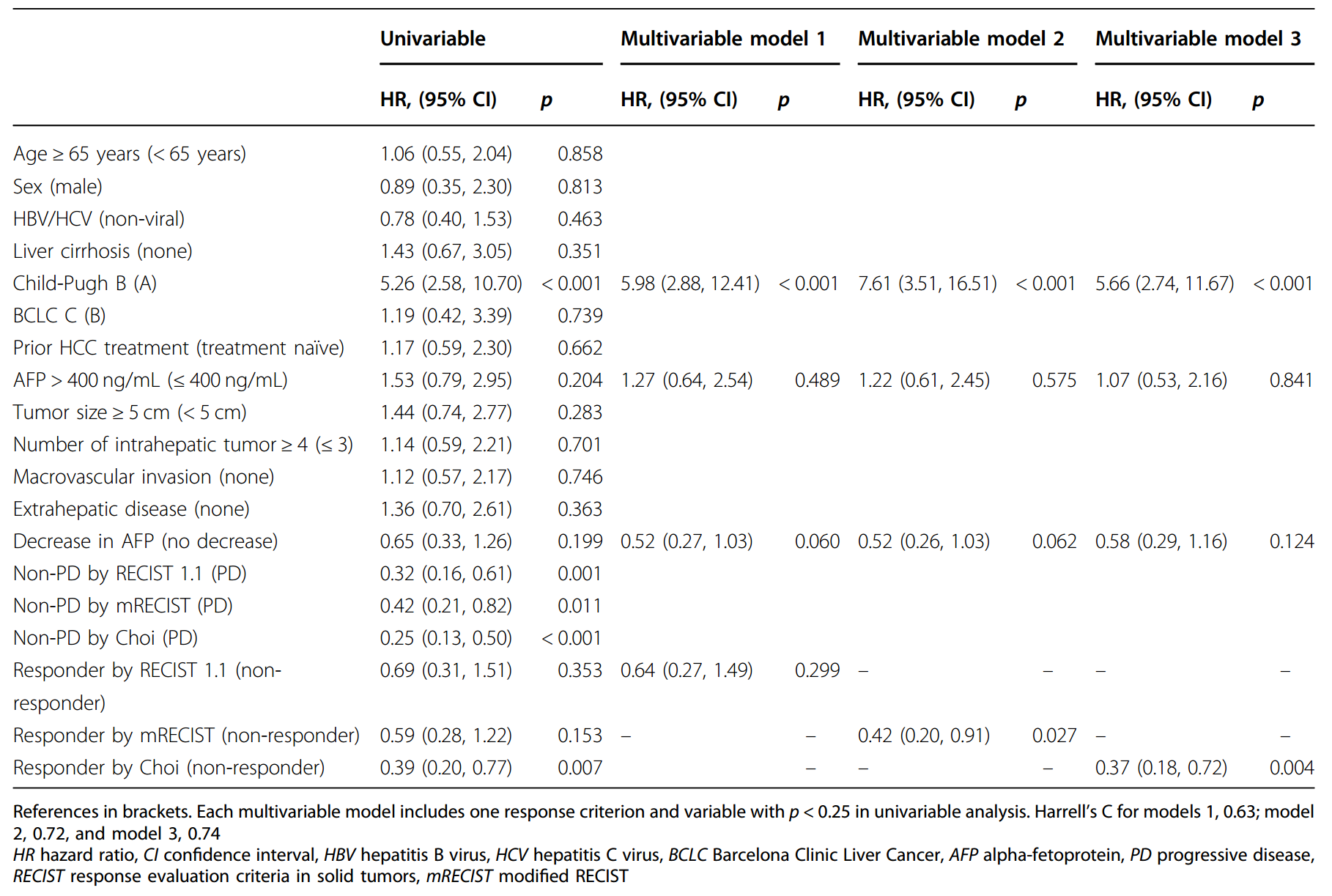
OS单变量和多变量分析
PFS和OS的单变量和多变量Cox分析显示,所有标准的反应状态均显著预测更好的OS。在三个多变量模型中,每个模型包括一个反应标准和临床因素,结果显示年龄< 65岁,AFP > 400 ng/mL,AFP未下降,任何标准的无反应与PFS恶化有关。对于OS,只有符合Choi标准的应答者与更好的OS显著相关。值得注意的是,任何标准的PD均与较差的OS显著相关。
在证明了优于索拉非尼的生存益处后,atezo-bev被推荐作为晚期HCC的一线治疗。这一转变标志着需要测试和验证基于细胞毒性治疗的传统反应标准。mRECIST和Choi标准旨在考虑RECIST 1.1经常遗漏的治疗性坏死,在接受索拉非尼或仑伐替尼治疗的HCC患者中产生更高的ORR。与其他标准相比,Choi标准测量的是肿瘤区域的更高密度,可以更客观、全面地反映肿瘤的异质性生存能力。此外,较低的大小变化阈值(10% vs RECIST的30%)有助于更敏感地识别应答者。
该研究比较了RECIST 1.1、mRECIST和Choi标准的早期应答率并评估了它们与生存结果的关系。发现Choi和mRECIST标准比RECIST 1.1标准显示出更多的应答者,对PD的识别一致。这减少了在不同标准中评估PD的偏差风险,从而最大限度地减少了过早停药的可能性。并证明了Choi标准在预测atezo-bev治疗患者更好的OS中的作用。
参考文献:
[1] Kim, D. H., Min, E. J., Kim, B., Choi, J. Y., Jang, J. W., Sung, P. S., Han, J. W., Kim, H., & Choi, J. I. (2024). RECIST 1.1, mRECIST, and Choi criteria for evaluating treatment response and survival outcomes in hepatocellular carcinoma patients treated with atezolizumab plus bevacizumab. European radiology, 10.1007/s00330-024-10986-z. Advance online publication.
https://doi.org/10.1007/s00330-024-10986-z
南晓敏 撰写 / 秦维伟 审核