



 有临
有临
 2020.05.19
2020.05.19
 4303
4303
《药物临床试验质量管理规范》(简称GCP)是药物临床试验全过程的技术要求,也是药品监管部门、卫生健康主管部门对药物临床试验监督管理的主要依据,其适用于为申请药品注册而进行的药物临床试验,并且药物临床试验的相关活动都必须遵守此规范。
2020年4月26日,新版《药物临床试验质量管理规范》正式上线,并预计2020年7月1日起取代原2003版GCP施行。
新版GCP从原九千多字增加至二万四千多字,与原目录结构相比,从原有的十三章七十条调整为九章八十三条。在保留了总则以及研究者和申办者等临床试验过程中重要角色相关内容的基础上,对其余多项章节进行了删改整合。
一个值得关注的点是术语章节位置的大幅提前。在03版GCP中,术语部分内容出现在第十三章附则中,共有十九个条目解释规范的用语含义说明。而在新版GCP中,术语及其定义部分内容被提前到了第二章,增加到四十个条目数。这种术语章节前置的排版方式不仅规范了后续数量繁多的各类条文中的术语,而且直接帮助读者在理解的基础上,更好地掌握规范的要求。
笔者注意到其中一个术语 - 临床试验的依从性,其明确定义为:“临床试验参与各方遵守与临床试验有关要求、本规范和相关法律法规。”这一术语为03版GCP所没有,而与ICH-GCP E6(R2)的术语解释一致。在新版规范中类似的修订还有很多。
2017年中国加入ICH(人用药品注册技术管理国际协调会)提交的是“有条件加入ICH的申请”,这意味着中国各项法规将在一段时间内逐渐达到ICH的所有要求的长期过程。新版GCP与ICH-GCP E6(R2)从结构到细节的相似正是慢慢贴近ICH标准的一种体现。
对标国际规范,对具体要求有详细的描述,明确责任主体等,使得新版GCP有着更好的可操作性。以上述术语为例,新版GCP在第五章第五十三条中明确“申办者应当保证临床试验的依从性。”指出当申办者发现在临床试验中不遵守试验方案、标准操作规程、GCP规范和相关法律法规时,根据情节轻重,可以分别“采取措施予以纠正”、“ 追究相关人员的责任,并报告药品监督管理部门”,直至“终止该研究者、临床试验机构继续参加临床试验”。
关于申办者,新版GCP用了一个章节(第五章)二十八项条目共八千五百多字的内容,明确了其在临床试验中的主体地位及各项职责,是临床试验数据质量和可靠性的最终负责人。
但是,主要研究者却是临床试验质量的第一责任人,应当监管所有研究人员执行试验方案,并实施临床试验质量管理,确保源数据真实可靠。新版GCP在第四章关于研究者的内容全方位接轨了ICH-GCP E6(R2)的各项要求和规定。归纳起来,共计13项条款从研究者资质和职责到各项报告的内容和路径均做了详细的说明。
为了便于研究者在繁忙的工作中尽快检索到具体要求,笔者对有关研究者章节中的13条内容做了如下简表说明:
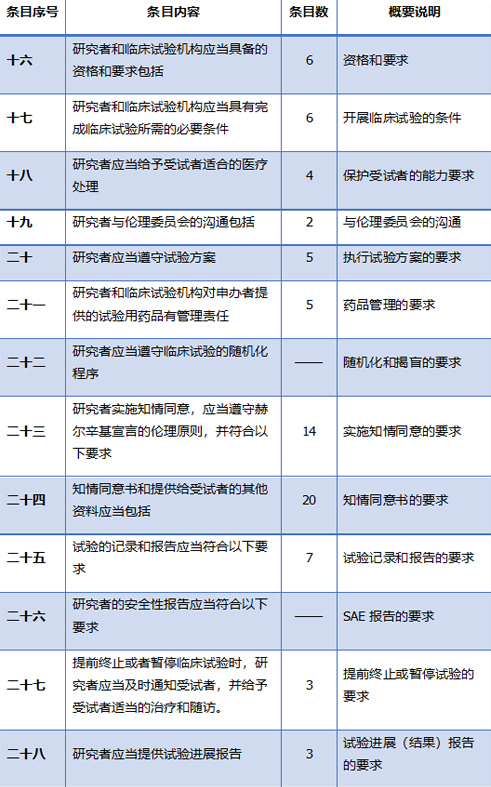
总之,与以往不同的是,由国家药监局和国家卫健委两部门联合发布的新版GCP,意味着药物临床试验将由两部门的共同参与管理。这对于在新形势下,加强受试者的保护,加强临床试验机构的管理,在保证药物临床试验质量的同时,提高医疗质量、保障医疗安全,具有划时代的重大意义。