



 有临
有临
 2021.12.30
2021.12.30
 11379
11379

临床试验申请前会议(pre-IND会议)通常是指创新药进行临床试验前申请人与药监部门沟通交流的会议,申请人可就I期临床试验的问题与药监部门进行沟通。2020年12月11日CDE发布的《药物研发与技术审评沟通交流管理办法》[1]用于指导申请人如何与CDE进行沟通。对于计划向FDA申请IND的申请人,可参考2017年FDA发布的指南《Formal Meetings Between the FDA and Sponsors or Applicants of PDUFA Products》[2]。本文将介绍如何在新药I期临床试验前向FDA申请pre-IND会议,其流程与要求如下:
01、 会议目的及申请前需知
FDA Pre-IND会议主要审查药学研究与非临床试验试验研究,并讨论现有研究结果是否足以支持开展临床研究;讨论I期临床试验范围及设计方案;新药儿童药物研究计划;IND注册申请数据的最佳呈现方式等[3]。它可以减少临床试验暂停(clinical hold)的发生,并协助申请人更顺利地开展临床试验。
FDA不强制申请人向其申请pre-IND会议。任何IND均可向FDA申请pre-IND会议,尤其鼓励以下几种情况申请:1)从未批准的新药;2)新分子实体(NME),特别是具有全新药理作用机制的;3)具有以505(b)(2)注册路径递交上市计划的新药;4)对公共健康起关键作用的有效药物(如反恐药物,治疗严重威胁人类生命或严重破坏人类健康的药物);5)人类因子工程计划药物;6)大量早期研究未在美国进行的药物;7)具有充分的对照研究支持申请新适应症的药物[4]。但申请人应在申请前尽量利用公开资源中与其产品开发相关的知识解决其问题,如ICH指南、FDA指南、FDA网站和数据库等。
02、会议类型
Type B。
FDA的会议类型分为Type A、Type B、Type B(EOP)、Type C四类,Pre-IND归属于Type B。
03、会议形式
FDA会议形式包括:面对面、视频会议、电话会议、书面回复。
对于pre-IND申请,FDA通常认为书面回复最合适。特殊情况下可以其他会议形式召开。
04、会议申请
会议申请材料应清晰表述希望FDA帮助解决的问题。
4.1 申请材料应该包括:
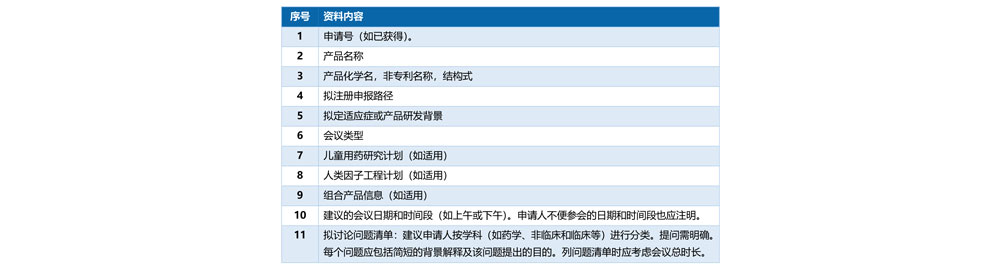
4.2 申请材料还必须包括:

会议申请资料通过纸版邮寄或电子通道递交至FDA(传真/邮件文件仅作副本,不作为正式递交文件)。
05、会议申请结果
FDA将于收到Pre-IND会议申请后21天内书面回复拒绝或同意会议。
5.1 拒绝申请
其可能的原因包括:
5.1.1 产品尚处于研发早期,会议申请过早;
5.1.2 会议申请资料规定需提交的信息严重欠缺;
注:被拒一般会有明确的原因,不会仅因为申请材料稍有欠缺而拒绝。
5.1 同意申请
5.2.1 面对面会议/电话会议/视频会议:FDA确定会议日期、时间、会议安排、地址及FDA拟出席会议人员。
5.2.2 书面回复:FDA确定书面回复日期。
注:除特殊情况外,FDA一般都会同意Type B会议申请。但除非FDA认为申请人多次会议诉求不相关(比如工艺和临床),需要分次召开会议,否则至多允许同一申请人的同一药物在每个注册阶段申请1次Type B会议(已认定突破性疗法除外)。
06、会议资料
会议前至少30天提交会议资料。
申请人需提交产品总结资料及FDA所需的其他补充信息。提交资料前需考虑是否符合FDA、ICH的相关指南。
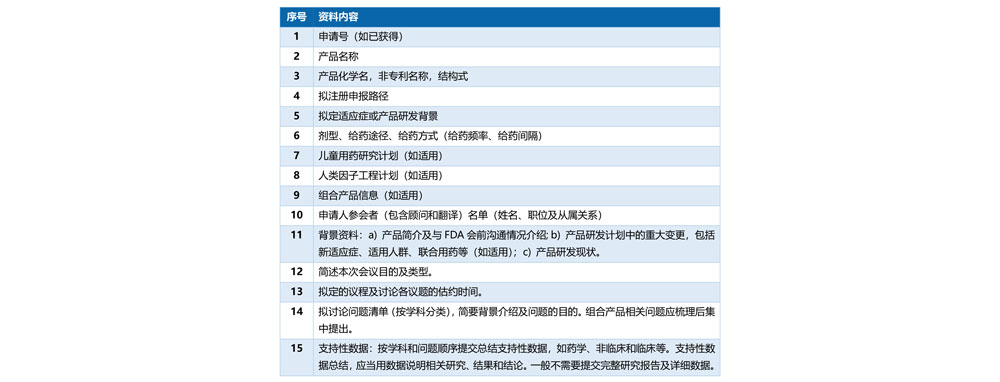
07、FDA初步审评
FDA收到会议资料后将进行内部讨论,并于拟定会议日期前至少2天进行首次回复。若申请人认为FDA的首次回复已解决其问题,可联系FDA项目经理(PM)申请取消会议。
08、会议延期/取消
8.1 存在下列情形之一的,会议延期:
1) 会议资料提交延期。申请人需向PM解释延期理由及何时能提交;
2) FDA认为会议资料不够充分,需要申请人尽快补充资料;
3) 会议资料提交文件量过大,FDA来不及完成审评;
4) 会议资料提交后,申请人再次向FDA补充提交需要讨论的其他问题/数据;
5) 关键参会人员无法按时参会。
8.2 存在下列情形之一的,会议取消:
1) 约定日期前FDA未收到会议资料,或资料准备严重不足;
2) FDA首次回复后,申请人的问题已解决。
09、会议召开
会议于申请后60天内召开。由FDA工作人员主持,依事先确定的会议议程进行。通常申请人无需准备PPT。如果申请人仍计划在会议中展示PPT,应提前和PM沟通确认是否必须,且需预留足够时间用于问题讨论。PPT应简洁明了。如果PPT中提到了大量会议资料中未涵盖的新增内容,FDA可能不会对此给予评价和建议。
10、会议纪要
会议纪要包括会议共识、分歧、待讨论问题,及经讨论得出的解决方案。FDA将于会议后30天内将会议纪要定稿并发送至申请人,并作为重要文档存档。若申请人阅读会议纪要后发现双方理解存在偏差,可联系PM进行确认。
综上,FDA的pre-IND会议流程和要求与国内有相似之处但也存在差别,当申请人计划向FDA申请时需引起注意。
有临医药注册事务
有临医药为客户提供医药申报注册和法规策略咨询服务,在FDA和NMPA均得到行业专家的支持,已成功帮助国内外知名企业取得IND申报项目的批准。我们的业务范围(FDA/NMPA)包括:法规策略咨询,Pre-IND会议,IND申报文件整理、撰写及审阅。
参考文献:
[1] 药物研发与技术审评沟通交流管理办法, CDE, 2020.
[2] Formal Meetings Between the FDA and Sponsors or Applicants of PDUFA Products, FDA, 2017.
[3] 21CFR 312.82(a).
[4] Good Review Practice: Best Practices for Communication Between IND Sponsors and FDA During Drug Development, FDA, 2017.
部分图片来源于网络