



 有临
有临
 2021.12.24
2021.12.24
 3709
3709
今年六月,复星凯特生物科技有限公司申请CAR-T细胞治疗产品益基利仑赛注射液正式获批,用于治疗二线或以上系统性治疗后复发或难治性大B细胞淋巴瘤等血液病。这是中国首款获批的CAR-T细胞治疗产品。随后不到三个月,药明巨诺的瑞基奥仑赛注射液也得获批准,成为中国第二款获批的CAR-T细胞治疗产品。目前全世界共有6款CAR-T细胞治疗产品,中国就有其1/3。有国际商业咨询公司分析称:预计全球CAR-T细胞疗法市场将从2019年7亿美元增至2024年66亿美元。预计到2030年中国的CAR-T细胞疗法市场规模将可能达到289亿元,复合年增长率为45%。最近的Insight数据库显示,CAR-T细胞疗法在CDE注册的临床试验项目有21项,正在申报的项目有47项。可以预计CAR-T细胞治疗在中国必将迎来一个新的生物制药的高潮。
CAR-T是嵌合抗原受体T细胞(Chimeric Antigen Receptor T-Cell)的英文缩写,CAR-T疗法也是免疫治疗肿瘤的方法之一(点击查看☞概览:癌症的免疫疗法
)。CAR-T的工作机理是利用T细胞在体内杀灭被病毒感染的细胞的原理。自然状态下,T细胞能在T细胞抗原受体(T cell antigen Receptor)的帮助下,检测到被病毒感染的细胞并对之发起攻击。CAR-T就是将肿瘤细胞所表达的特异性抗原,又称作肿瘤靶点,嵌合到患者的T细胞里,使得被修饰过的T细胞可以识别出癌细胞,并消灭肿瘤。现在用的最多的肿瘤靶点有CD19、CD20、CD22、GPC3、BCMA等。上述两个国内率先获批的CAR-T细胞治疗产品的靶点均为CD19。
将肿瘤靶点嵌合到T细胞生产出有足够数量可以起到治疗效果的CAR-T细胞治疗产品,需要经过一个相当复杂的技术过程。首先病人需要在病房接受血细胞单采,通过特定的冷链系统转运到实验室,去完成一系列的转基因操作以制作CAR-T细胞治疗产品。在实验室里,先要用特别的溶液分离出患者提供的血液里的单个核细胞(PBMCs,Peripheral blood mononuclear cell),并通过流式细胞术(FCM)检测白血病细胞比例,用特定的抗体激活PBMCs,再用特殊的培养基中培养使其繁衍增加。被处理过的PBMCs被带有肿瘤靶点编码的、处理过的相对安全的病毒载体转导,形成CAR-T细胞,在整个实验室的制作过程中,需要严格控制支原体,内毒素,细菌和真菌等一系列有害微生物。完成制作的CAR-T细胞产品还需对细胞活性、扩增倍数、转导效率等一系列指标进行放行检测,符合标准的CAR-T细胞治疗产品才可以用于患者。
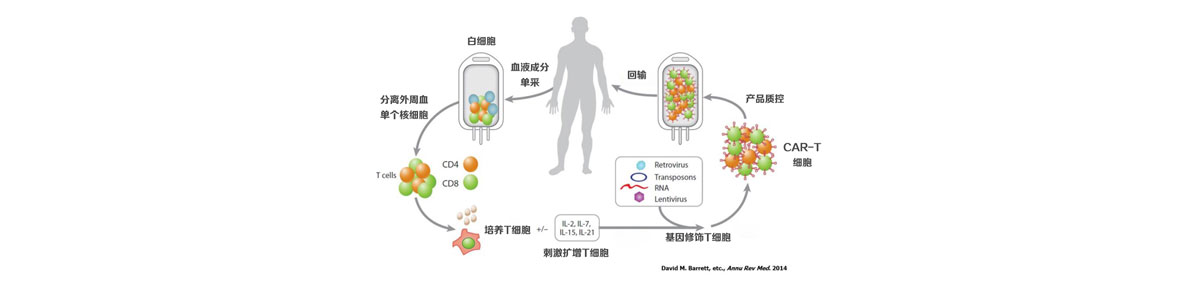
通常生产一个CAR-T细胞治疗产品需要一个月左右的时间。而患者在接受CAR-T细胞回输前,还需要接受一系列的清除淋巴细胞等预治疗,以使得回输的CAR-T细胞不会被患者的其他免疫细胞灭活。从这可以看出,CAR-T细胞治疗产品从准备到治疗的整个过程都是非常个性化的,是由一个患者产生出的一个独特的产品,而且这个产品的质量不仅取决于制备过程的技术,患者本身的疾病和身体条件也对CAR-T细胞治疗产品的质量和治疗效果有很大的影响。因此,不难理解CAR-T细胞治疗产品价格昂贵,治疗效果却差异很大。
目前影响CAR-T细胞治疗产品疗效的主要因素有两方面:一是来自患者自身的身体和疾病的状况,另一是治疗后的不良反应发生的情况和程度。CAR-T治疗的常见不良反应主要有细胞因子释放综合征(cytokine release syndrome,CRS)(点击查看☞什么是免疫应答、过敏和细胞因子风暴)、神经系统毒性、脱靶效应等。尽管第一例CAR-T细胞治疗的患者已经完全康复进入了第九个年头,而对CAR-T细胞治疗来说,最大的挑战来自于患者5年内完全无复发率还未达到预期水平。
幸而,最近有报道称,目前有多款CAR-T细胞治疗技术可以实现在初步治疗时达到100%的反应率;而世界首款CAR-T细胞治疗产品上市后4年的数据显示,长期缓解率达到了44%。因此,我们完全有希望看到,在未来CAR-T细胞治疗产品在肿瘤治疗的领域里发挥出更大的威力。