



 有临
有临
 2022.09.15
2022.09.15
 7817
7817
剂量递增方案的确定要考虑起始剂量与药效学有效剂量和毒性剂量之间的距离、毒代和药代动力学特征等因素。通常采用费氏递增法(改良的Fibonacci法)设计剂量爬坡方案,即当初试剂量为n时,其后按顺序递增的剂量分别是2n、3.3n、5n、7n,此后则依次递增前一剂量的1/3。其特点是开始递增速度快,后期增速较慢,在确保受试者安全的情况下,以合理的速度和梯度迅速达到耐受性临床试验的终止目标。
另外剂量递增设计还有固定比例递增法,即剂量按照固定比例递增,但临床实际应用较少。

对于剂量递增,也可根据具体药物的自身特点,设计更具针对性的剂量递增方案。 剂量递增的基本原则:初期递增幅度可较大,后期递增幅度应较小。递增系数过小,会增加不必要的受试者例数;递增系数过大,会增加受试者的危险性。安全性大或毒性小的药物剂量递增幅度可大,有的可成倍递增;安全性小或毒性较大的药物剂量递增幅度应小。 具体的递增方式设计包括非参数设计和参数设计。
非参数设计
非参数设计方法严格按照已设计的方案要求,将病人分配到各个不同剂量水平。这些剂量水平内往往也包括MTD和Ⅱ期临床推荐剂量。非参数设计的最大特点是并不对剂量-毒性曲线作出事先的假设。
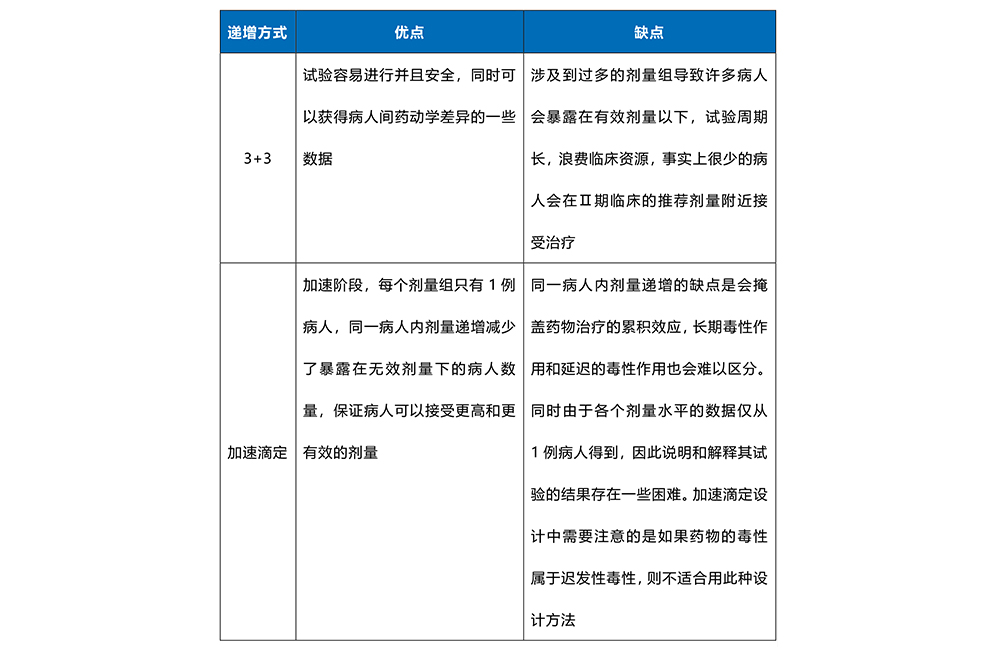
具体的递增方式包括传统的3+3、加速滴定、由药理引导的剂量递增设计(PGDE)等,各递增方式的优缺点见下表。
参数设计
参数设计主要是利用贝叶斯统计方法,通过确定先验概率和病人是否发生剂量限制性毒性来计算后验概率。某一病人所计算出的后验概率是决定下一病人是否进行剂量递增的选择标准。
具体的递增方式包括改良式连续性评估设计、结合毒性发生时间的剂量递增设计等,各递增方式的特点具体如下。
改良式连续性评估设计
连续性评估设计原理是:假设在靶剂量处达到可接受的毒性发生率,此时提前明确一个起始剂量,治疗一组病人后,收集其毒性反应的数据,并用已选好的数学模型拟合所获得的数据,从而利用其推断最佳剂量,为下一组受试者所用,且每一次分析所用数据即为在此之前所获得的所有数据。之后CRM便是一个不断重复的过程,直到计算所得剂量不再变化或者预定数量的病例全部得到了治疗。
改良式连续性评估设计主要有以下几个步骤:试验开始前确定剂量-毒性曲线的函数,常用的函数模型有(1)双曲函数模型(hyperbolic tangent model),(2)单参数逻辑回归模型(one-parameter logistic model),(3)双参数逻辑回归模型(two-parameter logistic model)。研究者必须根据药物临床前试验决定欲使用的模型。对剂量—毒性曲线预估时,用已进行试验的病人的数据绘制出剂量—毒性曲线后,如果其后一例病人出现剂量限制性毒性,则剂量—毒性曲线将往上方曲线调整。相反,如果后一例病人没有出现剂量限制性毒性,则剂量—毒性曲线将往下方曲线调整。
剂量递增的幅度:一般药物的递增方式采用改良的Fibonacci数列(modified Fibonacci sequence),即采用2, 1.67, 1.5, 1.4, 1.33, 1.33 …… 1.33倍的方式递增。研究者应该根据临床前实验数据,来决定他所要采用的药物递增方式,例如可以用log增量或使用常数增量。
每个剂量组的病人数目:O'Quigley提出的设计中每个剂量组只有1例病人,在改良式连续性评估设计中,研究者可以根据实际情况确定每个剂量组需要几例病人(通常是1-3例)。
目标毒性水平确定(target toxicity level):在正式实验前,研究者必须要先确定目标毒性,一般所研究的药物如果毒性较强,则界定的范围在0.2-0.3之间,如果药物毒性较弱,或者属于需要长期使用的药物,则一般界定于0.1-0.2之间。
试验终止原则:改良式连续性评估设计的试验终止原则一般是在试验前预先设定病人总数量,当病人数目达到预先设定的数目时,则终止试验。另外较好的终止原则是当试验模型预测的下一个剂量固定在某剂量不再变化,而且该剂量已有6例病人接受试验,则试验终止,并且该剂量确定为最大耐受剂量。
结合毒性发生时间的剂量递增设计
一般情况下,药物的毒性反应发生在给药一两次后,如果某些药物存在累积毒性、迟发型毒性等情况,则很容易使后面入组的病人暴露在没有及时发现的毒性剂量下,这就要求进行I期临床试验时,延长观察时间。有学者把给药后毒性反应发生的时间结合起来考虑到连续评性估模型中,预测毒性发生时间。采用此方法可以提高I期临床试验的效率。
总结
有临医药从对病人的治疗效果方面考虑,新的参数设计方法通常比传统的3+3设计在更有优越性。因为病人经常可以接受到Ⅱ期临床推荐剂量附近的剂量,同时也缩短了剂量递增的时间。但是尽管新方法有许多有优点,真正用于临床试验的还是比较少。目前上市的大多数抗肿瘤药物,在Ⅰ期临床试验时均采用传统的方法。但随着剂量递增设计方法的不断成熟,参数设计将会更多地被应用于抗肿瘤药物Ⅰ期临床试验中。