



 有临
有临
 2022.05.06
2022.05.06
 4583
4583
从临床前到临床的过程中,定量药理将通过预测起始剂量、有效剂量和毒性剂量等方式助力临床方案的设计与优化;在早期临床和关键临床阶段,临床药理研究可以加速确定单次给药剂量、给药频次、给药人群、适应症等,帮助研究者指导药物研发,通过量身定制的给药剂量,为治疗个体化提供建议,从而降低研发成本,缩短研发时间,规避临床风险,最大限度地提高临床试验的成功率[1]。
单克隆抗体(mAbs)具有复杂的药理学、相互依赖的药代动力学(PK)和药效动力学(PD)特性,是一类重要的治疗药物。单克隆抗体药物是由抗原结合域(Fab)和可结晶区域(Fc)组成。Fab段由轻链和部分重链构成,主要特异性识别相关抗原,进而调控下游信号通路;Fc段则由剩余的重链部分构成,可识别并结合表达Fc受体的免疫细胞(如自然杀伤细胞、巨噬细胞和中性粒细胞) 以及补体,以激活相应的免疫应答,介导抗体依赖性细胞毒作用(ADCC)、抗体依赖的细胞吞噬作用(ADCP)以及补体依赖细胞毒作用(CDC)等效应,mAbs结构特点见图1。
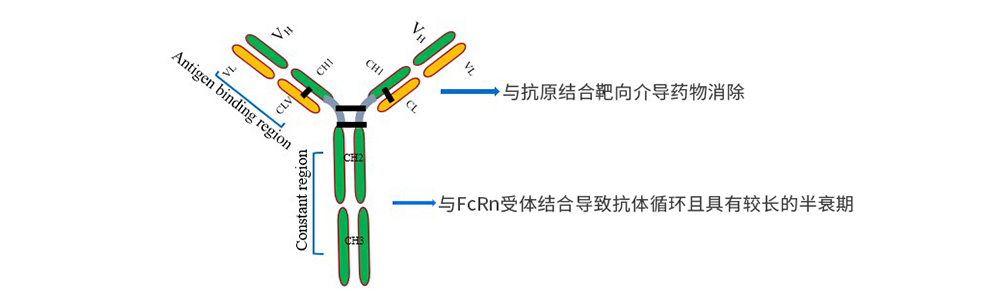
图1 mAbs结构特点
目前市场上的单抗隆抗体均来自自身免疫球蛋白G(IgG)亚型(IgG1、IgG2、IgG、),该药物具有相似的PK特性,如清除缓慢、半衰期长、组织分布受限等。单抗隆抗体的PK特性是独特的,因为它们依赖于自身的结构,也可能受到其目标抗原的生物学特性的显著影响。本文对单克隆抗体的PK特性进行总结。
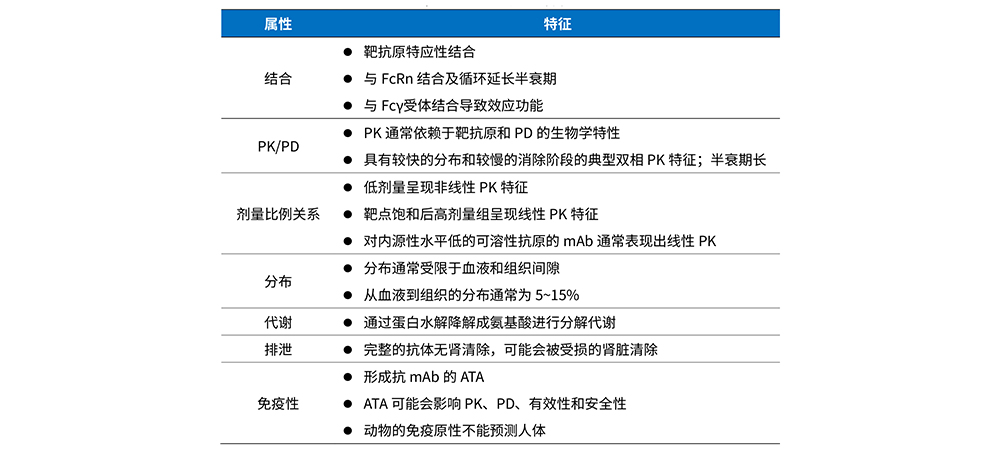
表1 mAbs的PK特征
吸收
由于单抗的相对分子质量较大,膜通透性较差,同时在胃肠道系统中易于分解,导致单抗口服生物利用度几乎可以忽略,因此,这类药物主要的给药方式是注射给药,包括静脉注射、皮下注射或者肌肉注射等。皮下注射给药后的生物利用度变化很大,可能在20%~95%之间,而且很可能通过淋巴系统促进吸收。决定单抗药物生物利用度的因素包括在给药部位的分解代谢作用、细胞的内吞作用以及通过FCRn介导的再循环作用。单抗类药物的吸收途径,导致其吸收较为缓慢,通常约为1 ~8d达到峰浓度。
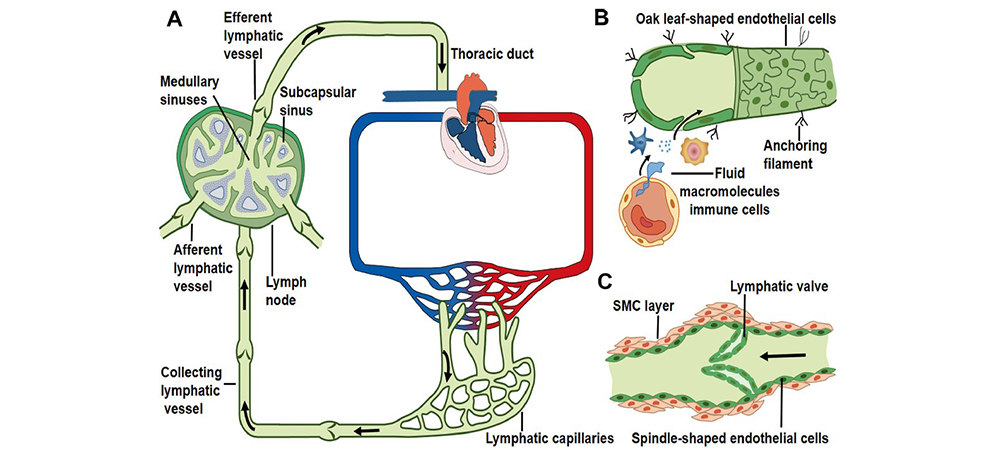
图2 单抗类药物通过淋巴系统转运示例图[2]
分布
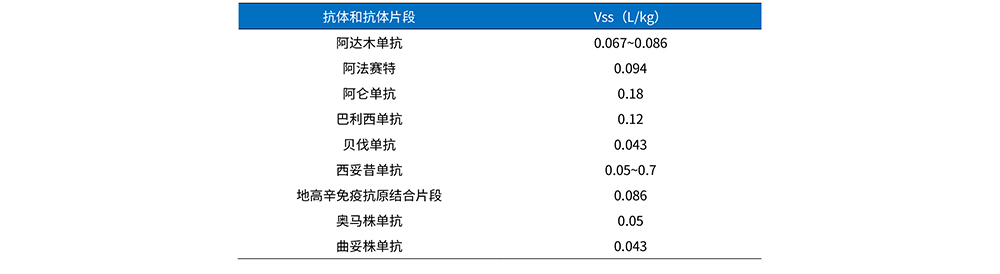
由于单抗药物分子体积大和极性高的特征,导致其难以通过扩散的方式分布进入组织,其分布体积均在血浆(0.04L/kg)和细胞外间隙(0.23L/kg)之间,见表2。单抗药物在组织中的分布主要是由对流作用以及抗体细胞间的结合作用所决定的;其他影响单抗药物组织分布的因素包括:扩散、胞饮作用、受体介导的胞吞作用以及单抗的生物学特性。在与抗原特异性结合的情况下,结合亲和力、受体表达、受体翻转动力学和抗原抗体等方面都会影响分布。此外,抗体相对分子质量大小同样也对单抗的分布具有影响,例如阿达木单抗(adalimumab,约148 kD)的稳态表观分布容积( Vss)为5.1 ~ 5.7 L,而阿那白滞素(anakinra,约17 kD)的Vss为10.1L。单抗从血液循环进入大多数组织的程度一般在5%~15%之间。
表2 单抗类药物分布体积[3]
消除
单抗药物的相对分子质量较大,无肾小球滤过,肝脏代谢作用,只有部分相对分子质量低的单抗片段( Fab或Fv)能够通过肾小球滤过,而被滤过的单抗药物不是直接被排出体外,而是被肾脏再吸收或被近端小管的细胞代谢。单抗类药物消除主要依靠在机体各部位细胞的内吞作用,再于细胞内分析代谢,绝大多数免疫球蛋白的消除是通过分解代谢(Fc受体介导和靶点介导),不论是内源性的IgG还是外源性的含功能性,Fc片段的治疗性IgG单抗,均可以由该方式进行消除。介导这一消除的受体是Fcγ,它包括FcγRI1和Ⅲ3种亚型。单抗与FcγR结合后能够激活细胞的内吞与水解作用,从而介导抗体的消除。与介导抗体消除的Fcγ受体相反,FcRn受体对IgG的消除具有保护作用。通过胞吞作用进入核内体的IgG与FcRn受体结合后能够避免被细胞内的溶酶体降解。当lgG的浓度增加到能够饱和FcRn受体时,一部分1gG将不再受到FcRn的保护从而被溶酶体降解,因此IgG的消除速率将增加。
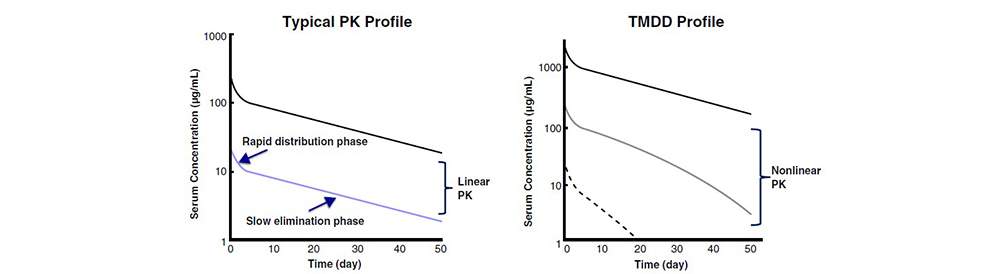
图3 mAbs的消除特征
小结
目前,仍然存在许多尚未解决的问题如SC生物利用度影响因素,Fc受体在药效和生物分布中的作用等,同时影响单抗类药物的PK因素也有很多,如电荷、糖基化、可溶性与可脱落靶点、患者因素对PK的影响、免疫原性对PK的影响、脱靶效应对PK的影响。在单抗类药物开发过程中,需对其PK特征进行深入的研究以最大限度地提高临床试验成功率。
参考文献:
[1] Kamath AV. Translational pharmacokinetics and pharmacodynamics of monoclonal antibodies. Drug Discov Today Technol. 2016 Sep-Dec;21-22:75-83. doi: 10.1016/j.ddtec.2016.09.004. Epub 2016 Oct 24. PMID: 27978991.
[2] Hang T, Liang J, Kapron CM, Liu J. Pathophysiology of aged lymphatic vessels. Aging (Albany NY). 2019 Aug 28;11(16):6602-6613. doi: 10.18632/aging.102213. Epub 2019 Aug 28. PMID: 31461408; PMCID: PMC6738433.
[3] Malcolm Rowland. Thomas N. Tozer Clinical pharmacokinetics and pharmacodynamics concepts and applications.2012.