



 有临
有临
 2023.11.29
2023.11.29
 1897
1897
抗肿瘤新药的研发过程通常经历药物发现、临床前研究、临床试验(I期、II期、III期)和上市后研究(IV期)的过程。临床药理学研究贯穿整个药物研发过程(图1),并且在研发早期进行临床药理学研究的次数比较多;后期也会进行相应的临床药物学研究,但相对研究早期研究阶段,研究数目有所减少。【1】在早期临床试验中,临床药理研究对于制定合理的试验方案和评估药物的安全性和有效性至关重要。
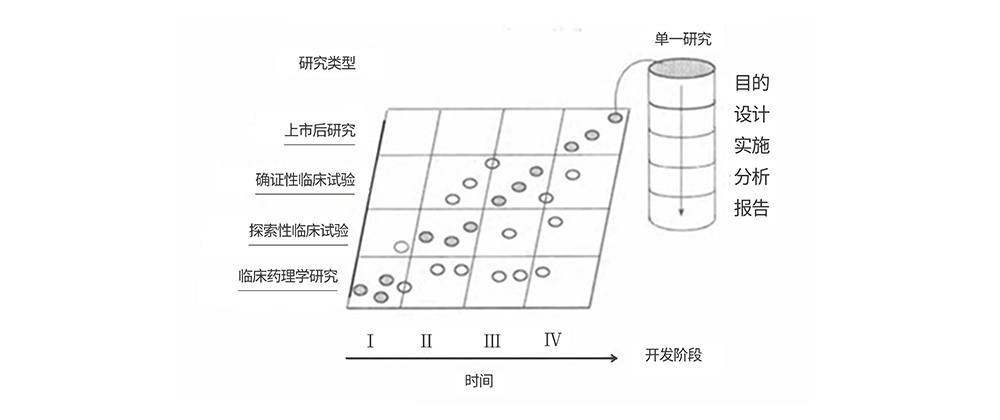
图1. 临床研发阶段与研究类型间的关。
(实心圆代表在某一研发阶段最常进行的研究类型,空心圆代表某些可能但较少进行)
1.初始剂量设定
大多数抗肿瘤药物的治疗指数很小,起始剂量较高则可能引起严重毒性,甚至导致患者死亡,从而导致原本具有潜力的有效药物不能继续研发。另一方面,起始剂量过低,则会导致研发周期较长,不利于开发进程,而且从伦理考虑,不应让患者进行过多无效暴露。因此,人体首次(first in human, FIH)剂量的确定是抗肿瘤药物早期临床试验决策的关键步骤。临床药理通过综合分析非临床药效、毒理和药代动力学/毒代动力学的研究结果,结合不同的估算方法,来推荐FIH剂量。基于药物的毒性特点,目前抗肿瘤药物可以分为细胞毒类和非细胞毒类的药物,因此FIH剂量的估算方法也略有不同。对于细胞毒类药物,FDA推荐采用啮齿类动物STD10 (10%的动物出现严重毒性反应剂量)的1/10,或者用非啮齿类动物最高非严重毒性剂量( highest non-severely toxic dose,HNSTD)剂量的1/6进行估算,单位用mg/m2表示。【2】欧盟根据最大耐受量(maximum tolerated dose,MTD)确定起始剂量,采用MTD剂量的1/10,通常采用小鼠,还需考虑在其他种属的毒性水平及毒性反应的量效关系,在未知动物相关性的情况,宜选择最敏感动物MTD进行计算。【3】对于非细胞毒类抗肿瘤药,起始剂量通常为非临床毒性试验中的NOAEL法,可采用非临床试验中非啮齿类动物NOAEL(no observed adverse effect level,未观察到不良反应的剂量)的1/5,或者更高。【4】如果非细胞毒类抗肿瘤药是在健康人中进行,则应参考《健康成年志愿者首次临床试验药物最大安全起始剂量的估算指导原则》。【4】抗肿瘤新药起始剂量选择比较复杂,除了除考虑毒性试验结果信息外,还需要结合药物作用机制或靶点、药效学、药动学等特点等来综合考虑。
2.药代与药效动力学研究
在早期临床试验中,通常进行的药代动力学研究包括人体单次和多次给药的药代动力学研究、食物对口服制剂影响、代谢物确证、生物转化、物质平衡、代谢物的药代动力学及生物活性等研究。对于抗肿瘤药物而言,上述的研究通常在患者中进行。药代动力学研究可以描述药物在体内吸收、分布、代谢、排泄特点,同时早期单次药代动力学研究结果可以指导多次给药的给药间隔等的调整。【4】药效动力学研究通常结合效应终点进行测定,在患者中依据药效学数据可以对药物活性与潜在有效性进行早期评估,而且还能为随后开展的在目标适应症人群中进行的给药剂量和给药方案的确定提供依据。同时临床药理应重点评估药代动力学与其给药剂量、安全性和临床疗效的关系。对于抗肿瘤的药物,患者的疾病状态可能对药物的药代动力学产生影响,因此,可在早期采用PK/PD模型进行研究,这将有助于解释毒性反应,设计最佳给药剂量和给药方案。
3.暴露-效应关系
早期临床耐受性试验通常是在健康受试者中进行的、以获得药物安全性信息为主要研究目的。而在抗肿瘤药物研究中,通常选择肿瘤患者作为研究对象,并结合开展药代动力学研究,以获得更多与安全性相关的暴露量-效应关系信息。【5】临床药理学研究可以在剂量范围内表征剂量限制及与暴露量相关的不良反应暴露-效应关系是临床药理学研究的核心内容。早期临床试验中对暴露量-效应关系的研究,对后续推荐合理的给药剂量与给药方案尤为重要。如,在一项I/II期研究(NCT01970865)中,研究评估了非小细胞肺癌患者洛拉替尼(B7461001)与所选安全性和有效性终点之间的潜在暴露-反应(E-R)关系。【6】对洛拉替尼I/II期研究的数据进行的E-R分析,确定了洛拉替尼与3≥级高胆固醇血症风险和TEAEs≥3级风险之间显著的暴露安全关系(图2); 未发现ORR或IC-ORR的暴露-功效关系。这些E-R安全性发现证实洛拉替尼100mg QD给药是可以耐受的,并支持批准的剂量调整指南。此外,E-R疗效研究结果表明,洛拉替尼100 mg QD可能在ORR和IC-ORR的反应平台期提供全身暴露,这支持了洛拉替尼100 mg QD的当前剂量推荐。
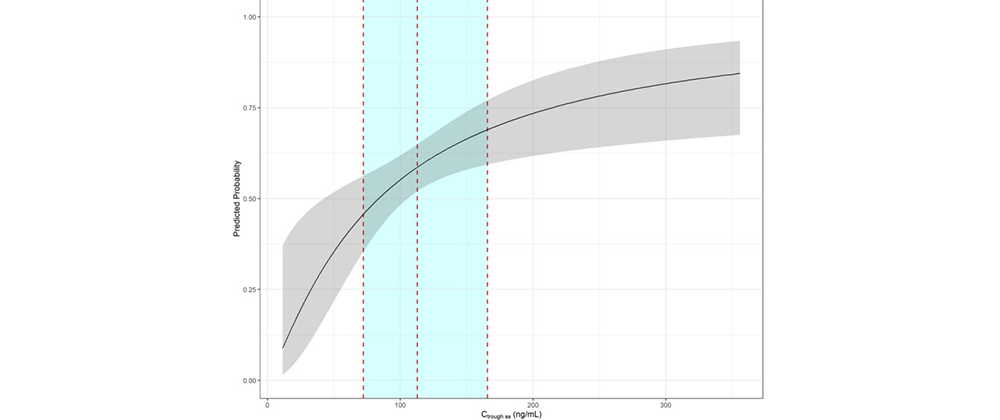
图2. TEAE等级≥3与Ctrough ss.的预测概率。
4.有临医药临床药理服务
有临医药提供专业的临床药理服务,业务包括:FIH起始剂量预测、PK/PD分析、PopPK/PD、E-R分析,临床药理研究方案设计(FE、MB、DDI、特殊人群等)。有临医药临床药理核心团队具有丰富的从业经验,另外还有多名知名临床药理专家作为技术顾问进行技术指导,为项目保驾护航。
参考资料:
【1】 国家药品监督局,《药物临床试验的一般考虑指导原则》,2017。
【2】 FDA. Guidancefor Industry Clinical Trial Endpoints for the Approval of Cancer Drugs andbiologics. 2007.
【3】 EMEA Guidance. Note for guidance on the pre-clinical evaluation of anticancer medical products.
【4】 国家药品监督局,《抗肿瘤药物临床试验的指导原则》,2012。
【5】 Pharmaceuticals and Medical Devices Agency. Guideline for Exposure-Response Analysis of Drugs.
【6】 Chen J, Ana Ruiz‐Garcia, James L P, et al. Lorlatinib Exposure‐Response Analyses for Safety and Efficacy in a Phase 1/2 Trial to Support Benefit–Risk Assessment in Non‐Small Cell Lung Cancer[J]. Clinical Pharmacology & Therapeutics, 2021.DOI:10.1002/cpt.2228.