



 有临
有临
 2024.03.20
2024.03.20
 1133
1133
RAS作为第一个被确定的人类原癌基因,是肿瘤中突变最为广泛的癌基因,在近30%的人类肿瘤中出现。RAS家族包括KRAS(Kirsten rat sarcoma viral oncogene homolog)、HRAS(Harvey rat sarcoma viral oncogene homolog)和NRAS(Neuroblastoma RAS virus oncogene homolog)3种亚型,编码HRAS、NRAS、KRAS4A和KRAS4B这4个蛋白。KRAS基因突变约占RAS基因家族突变的85%,并比RAS家族其他基因突变更易导致肿瘤的发生。
KRAS作为分子开关,通过在鸟苷三磷酸(GTP,guanosine triphosphate)结合的活性状态和鸟苷二磷酸(GDP,guanosine diphosphate)结合的非活性状态之间过渡,传输来自膜结合受体的信号以调节细胞过程。KRAS突变位置主要是4个热点密码子(12、13、61和146)。密码子12是所有4个热点密码子中突变频率最高的,其中G12D突变最常见,其次是G12V、G12C等。
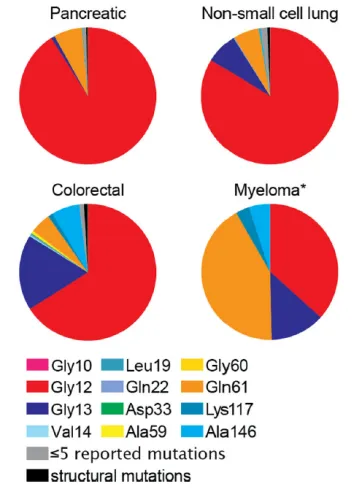
KRAS突变和/或KRAS野生型扩增在胰腺癌(美国发生率约90%,中国约87%)、结直肠癌(美国发生率约45%,中国约49%)和非小细胞肺癌(腺癌亚型中,美国发生率约35%,中国约13%)中十分常见。KRAS基因突变分布也因肿瘤类型而异,如图2所示。在美国,G12C在13.6%的肺腺癌中突变,而G12D和G12V是结直肠癌和胰腺癌中最常见的两种突变。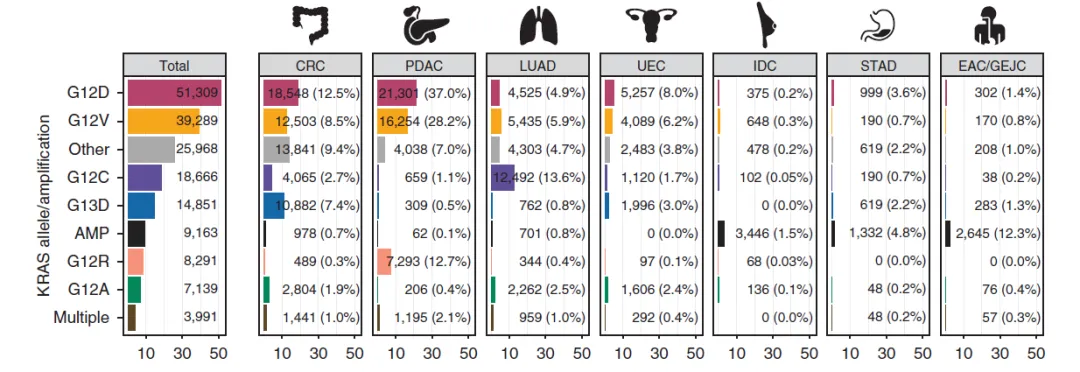
图2 美国各类KRAS突变每年新发例数及相应瘤种占比预估
KRAS被称为“死亡之星(Death Star)”蛋白,自1982年首次发现KRAS以来,它一直被认为是“无药可靶向的(undruggable)”。主要有以下几点原因:① RAS与GTP有皮摩尔级亲和力,而胞内GTP浓度达0.5 mmol·L-1,故竞争性抑制剂开发难度大;② KRAS蛋白表面平滑,空间结构近乎球形,缺乏小分子结合口袋;③ RAS各个亚型的D-domain高度类似,靶向选择性差。KRAS蛋白开关口袋II(switch pocket II)的发现以及凭借KRAS G12C突变新引入的半胱氨酸易形成共价键的特性,设计出了能够不可逆地靶向结合KRAS 12号密码子上半胱氨酸残基的共价小分子抑制剂,KRAS G12C靶向抑制剂得以实现药物上市,证明了KRAS突变并非“不可成药”。
而针对KRAS G12D突变至今仍无靶向药物上市。KRAS G12C突变已被临床证明受小分子共价抑制剂的直接抑制,这些抑制剂将蛋白质捕获在非活性GDP结合状态,然而KRAS G12D的GTP水解速率比KRAS G12C低2~3倍,从而导致更多的组成型激活。因此,尽管在GDP状态下存在类似的结合口袋,但针对非活性状态的药理学不太可能获得针对G12C的类似结果。此外,KRAS G12D突变是第12位密码子的甘氨酸(G)被末端为羧酸的天冬氨酸(D)取代,而此突变亚型缺乏开关口袋II附近的氨基酸残基进行共价结合,无法用选择性共价结合的策略,因此需要新的方法来开发具有高亲和力和类药物效力的选择性抑制剂。
目前全球靶向KRAS G12D的抑制剂研发最高阶段为临床II期,国内恒瑞医药的HRS-4642已进入临床I期。针对该靶点的药物类型,包括小分子化药、PROTACs、TCR细胞疗法和siRNA等,适应症为KRAS G12D突变实体瘤,主要队列包括非小细胞肺癌、结直肠癌、胰腺癌、子宫内膜癌等。
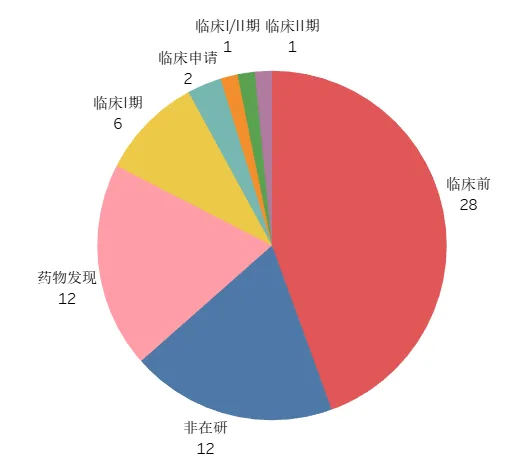
图3 全球KRAS G12D抑制剂最高研发状态分布
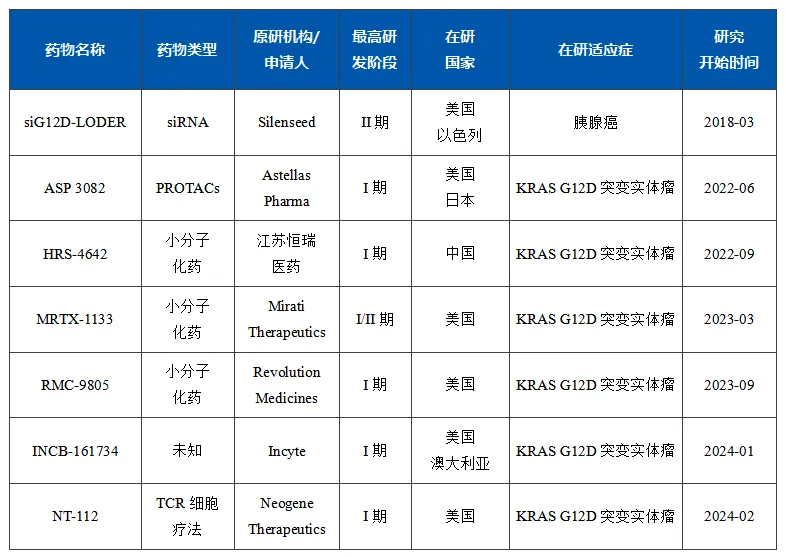
siG12D-LODER
siG12D-LODER是一种可生物降解的聚合物基质,含有针对KRAS G12D的siRNA。已在2011年进行了I期试验,后在2018年登记了II期临床研究,以探索siG12D-LODER联合化疗药物(吉西他滨+白蛋白紫杉醇或FOLFIRINOX或改良的FOLFIRINOX)治疗局部晚期胰腺癌患者的疗效。2020年ASCO年会公布该试验已入组了4例受试者,但后续未公布更多该试验结果。
MRTX-1133
MRTX-1133是Mirati Therapeutics公司研发的一种强效的、选择性的、非共价KRAS G12D抑制剂,在非临床研究中其对KRAS G12D的选择性是KRAS野生型的1000倍以上,半衰期大于24小时,没有潜在的hERG抑制作用,安全性相对良好,在3mg/kg水平就可以有效抑制G12D突变型移植瘤的生长。MRTX-1133在ClinicalTrials.gov已登记了一项I/II期临床研究。
HRS-4642
恒瑞医药研发的HRS-4642目前也已开展了I期研究,并在2023 ESMO年会上公布了其I期研究的阶段性结果。在已入组的18例受试者中,1例达到部分缓解(PR),疾病控制率(DCR)77.8%,53.8%的受试者靶病灶缩小。对于达到DCR的患者,中位治疗持续时间为2.4个月,50%左右的患者仍在接受治疗。
KRAS G12D在多种恶性肿瘤中均有发现,但至今仍未有一款有效的抑制剂成功上市。针对KRAS G12D突变的靶向治疗药物研发已成为备受关注的方向之一。KRAS G12D是占比最高的KRAS突变,也是在胰腺癌和结肠癌中占比最高的KRAS突变亚型,而胰腺癌又俗称“癌中之王”,本身治疗手段有限。开发KRAS G12D抑制剂的临床需求迫在眉睫。针对KRAS G12D的靶向疗法还处于相对早期的研究阶段。希望该靶向治疗疗法也能早日取得突破和进展,为更多患者带来新的治疗选择。
参考文献:
1. Management of Safety Information from Clinical Trials: Report of CIOMS Working Group VI
2. Johnson C, Burkhart DL, Haigis KM. Classification of KRAS-Activating Mutations and the Implications for Therapeutic Intervention. Cancer Discov. 2022 Apr 1;12(4):913-923.
3. Hofmann MH, Gerlach D, Misale S, Petronczki M, Kraut N. Expanding the Reach of Precision Oncology by Drugging All KRAS Mutants. Cancer Discov. 2022 Apr 1;12(4):924-937.