



 有临
有临
 2020.09.11
2020.09.11
 3582
3582
传统上,制药行业使用现场监控评估各中心的工作效能并解决其存在的问题。这种方法由定期访问各中心的临床研究监查员执行,以确保临床试验的过程顺利。该方法严重依赖大量的源数据验证(SDV)和源数据审核(SDR),以提供一定程度的广义质量控制,以确保受试者安全和数据的可靠。
每个临床试验都有庞大的数据量需要采集,无论最终因错误需要修改的数据比例是多少,都会是个无比浩大的工程。而当期望获得的数据质量无限趋近完美时,却可能不会得到与投入的人力、物力和财力相匹配的收益。那么在提高数据质量及管理效率的同时,如何评估其中可能需要承担的风险?基于风险的监查(Risk-Based Monitoring, 简称RBM)应运而生。而这一理念也在新版GCP中被正式提到了法规的高度。
新版GCP第四十九条提出:
申办者应当建立系统的、有优先顺序的、基于风险评估的方法,对临床试验实施监查。
申办者制定监查计划。监查计划应当特别强调保护受试者的权益,保证数据的真实性,保证应对临床试验中的各类风险。
现场监查和中心化监查应当基于临床试验的风险结合进行。
与传统监查相比,RBM 的理念显得更加先进,主要表现在具有前瞻性、目标性和灵活性。RBM可以基于电子化采集的小样本数据,分析错误的发生趋势,有针对性地对方案的不足进行及时修改、对研究者进行培训或再培训,形成对试验过程的系统化管理,有效预防和降低错误发生的风险。与传统的现场监查普遍按照每4~8周为周期的定期监查不同,RBM可以根据研究的风险评估结果,综合其他多种因素,定时或随时进行中心化监查或场外监查,根据各中心的风险点和风险等级,在需要的时候及时跟进现场监查,更易于保证研究的整体质量。
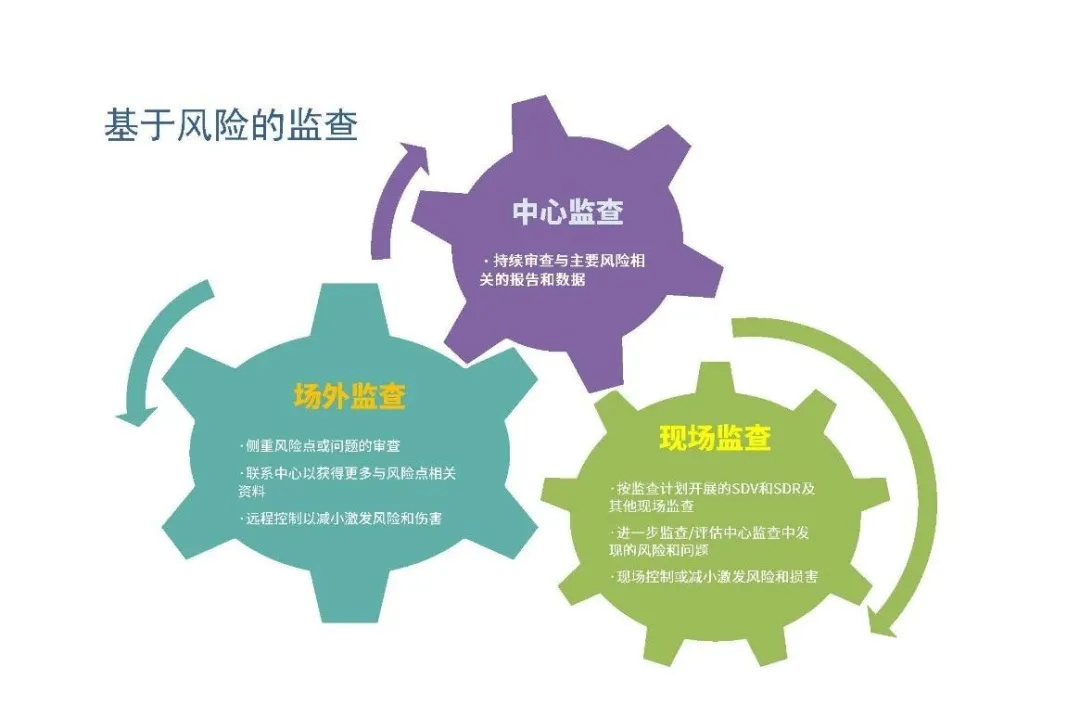
(图1-基于风险监查中的现场监查、场外监查和中心监查的重点内容)
因此,RBM中的风险评估尤为重要,主要风险、次要风险的分层,直接影响到监查工作从内容到时间的分配,反映出监查工作的重点。风险的分类应根据研究的性质,确定在方案实施、数据完整性和研究药物有效性方面至关重要的风险因素,将风险点分为高、中或低不同层级。例如,假设招募时间为某研究的关键风险因素,那么,对于一种难以招募受试者的研究来说,患者招募率即为高风险点。而对于相对容易招募受试者的研究来说,患者招募率的风险程度就可能有所下降,监查时便不需要密切关注受试者的招募进度。数据质量的监查也是同理。因此,良好的RBM计划需要描述研究中的所有关键风险点,并将之按程度进行分类。虽然每个临床试验项目风险点各有不同,侧重点也不同,但还是具有共性化的风险点值得关注。以下举例说明。
高风险点:
1.中心方案实施风险/关键风险指标:受试者招募/随机化比例;方案偏离/受试者不依从;CRF不完整的比率(过高);受试者终止/退出比率(过高);受试者随访超窗;
2.数据质量风险:关键数据不完全(如患者信息不全、主要疗效数据、安全性数据);关键疗效重点指标数据(数据离群、前后数据不合理);中心关键变量的相关性(如空腹血糖值和血红蛋白值);中心AE/SAE漏报或重复上报;
3.受试者病历:AE/SAE列表;关键疗效数据值列表。
中等程度风险点:
1.中心方案实施风险/关键风险指标:受试者筛查失败率;数据澄清表(DCF)生成率和未处理的问题;
2.数据质量风险:数据报告情况(数字偏好、数据取舍等);与病史和伴随用药有关的数据。
低风险点:
1.中心方案实施风险/关键风险指标:电子数据变更记录……
2.数据质量风险:数据缺失(如受试者住址)
总之,现场监查的平衡有赖于临床研究监查员(CRA)。CRA 仅凭既往经验,查看现场,检查数据质量,视角狭窄,不具有交叉试验甚或试验全局视角。RBM可以在一定程度上减少临床试验中的中心访视,改善监查活动为更有效的方式。数字时代的技术进步,赋予了医药企业临床试验中做出分析、推断、寻找风险的能力。完善的RBM计划将有助于进行无缝的研究管理,确保获得高质量的研究数据,更好地保障受试者的安全,同时可以提高新药研究申办者的成本效益。